题目内容
17. 下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )| A. | a的最高价氧化物对应水化物有两性 | |
| B. | b与d组成的化合物不能与水反应 | |
| C. | c的单质能与强碱反应生成两种盐 | |
| D. | c与d能形成共价化合物和离子化合物 |
分析 由元素在周期表中的位置可知,d位于第二周期,a、b、c位于第三周期,a原子的最外层电子数是电子总数的三分之一,令a原子最外层电子数为x,则2+8+x=3x,解得x=5,故a为P元素,由各元素在周期表中的相对位置可知b为S元素,c为Cl元素,d为O元素,结合元素周期律解答.
解答 解:由元素在周期表中的位置可知,d位于第二周期,a、b、c位于第三周期,a原子的最外层电子数是电子总数的三分之一,令a原子最外层电子数为x,则2+8+x=3x,解得x=5,故a为P元素,由各元素在周期表中的相对位置可知b为S元素,c为Cl元素,d为O元素.
A.a的最高价氧化物对应水化物为磷酸,不具有两性,故A错误;
B.b与d组成的化合物有二氧化硫、三氧化硫,均与水发生反应,故B错误;
C.氯气能与氢氧化钠反应生成氯化钠、次氯酸钠,故C正确;
D.c与d能形成化合物为氯的氧化物,属于共价化合物,故D错误,
故选:C.
点评 本题考查结构位置性质关系应用,比较基础,注意整体把握元素周期表,熟练掌握元素化合物性质.

练习册系列答案
相关题目
7.在1 000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=2.当水蒸气和氢气的物质的量浓度相等时,此反应( )
| A. | 已达平衡状 | B. | 未达平衡状态,反应正向进行 | ||
| C. | 未达平衡状态,反应逆向进行 | D. | 无法确定 |
8.链状单炔烃完全燃烧后生成的二氧化碳与水的物质的量之比为5:4,满足上述条件的烃的种数共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
5.a、b、c、d是原子序数依次递增的四种元素,a、b、c三种元素的原子核外电子数之和与Cl-的核外电子数相等,a、c分别得到一个电子后均形成稀有气体原子的稳定电子层结构,d是生活中用量最大的金属,其简单离子有两种常见价态,下列说法正确的是( )
| A. | 离子半径:c>b>a | |
| B. | a与c形成化合物的溶液有毒,要密封保存于玻璃瓶中 | |
| C. | a2b2与d的一种较高价态离子的盐溶液混合时会产生大量的b2 | |
| D. | d高价离子在溶液中与c的低价离子因发生氧化还原反应而不能大量共存 |
12.对于化学反应中的能量变化,表述正确的是( )
| A. | 氧化还原反应均为放热反应 | B. | 放热反应中,反应后体系能量降低 | ||
| C. | 断开化学键的过程会放出能量 | D. | 加热才能发生的反应均为吸热反应 |
2.化学与生活密切相关,下列说法正确的是( )
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
9.有机物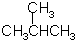 的名称是( )
的名称是( )
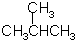 的名称是( )
的名称是( )| A. | 2-甲基丁烷 | B. | 2-甲基丙烷 | C. | 1,1-二甲基乙烷 | D. | 三甲基甲烷 |
7.下列说法正确的是( )
| A. | VSEPR模型就是分子的空间构型 | |
| B. | 在共价化合物分子中一定存在σ键 | |
| C. | Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 | |
| D. | 共价键键长越短,键能一定越大 |
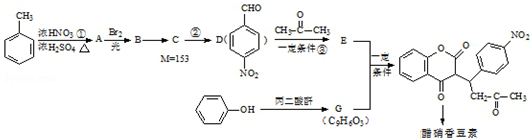
 +H2O
+H2O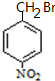 G
G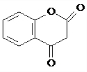
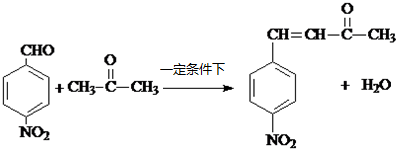
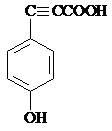 .
.