题目内容
7.下列说法正确的是( )| A. | VSEPR模型就是分子的空间构型 | |
| B. | 在共价化合物分子中一定存在σ键 | |
| C. | Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 | |
| D. | 共价键键长越短,键能一定越大 |
分析 A、VSEPR模型可用来预测分子的立体构型;
B、共价单键是σ键,共价双键有一个σ键,π键,共价三键由一个σ键,两个π键组成;
C、[Cu(NH3)4]Cl2的配位数都是4;
D、决定键能大小的不仅仅是键长,还有结构、元素的金属性和非金属性等.
解答 解:A、VSEPR模型可用来预测分子的立体构型,但不是分子的空间构型,故A错误;
B、共价化合物中一定存在共价键,共价键中一定有σ键,故B正确;
C、[Cu(NH3)4]Cl2的配位数都是4,故C错误;
D、决定键能大小的不仅仅是键长,还有结构、元素的金属性和非金属性等,故D错误;
故选:B.
点评 本题考查了分子构型的判定、共价键的类型以及键能等知识点,综合性较强,难度较大,注意有关概念的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17. 下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
 下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )| A. | a的最高价氧化物对应水化物有两性 | |
| B. | b与d组成的化合物不能与水反应 | |
| C. | c的单质能与强碱反应生成两种盐 | |
| D. | c与d能形成共价化合物和离子化合物 |
18.下列物质中,化学键类型(离子键、共价键)完全相同的是( )
| A. | HI和NaI | B. | NaF和NaOH | C. | Na2SO4和KNO3 | D. | F2和NaCl |
15.按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )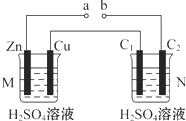

| A. | a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 | |
| B. | a、b连接,装置M中若有0.1 mol SO42-移到Cu电极,装置N中C2极放出H2 2.24 L(标准状况) | |
| C. | a、b未连接时,装置N中C1电极上有气体析出 | |
| D. | 不论a、b是否连接,装置M中观察到的实验现象相同 |
2.下列说法正确的是( )
| A. | 共价键都具有方向性 | |
| B. | σ键是镜像对称,而π键是轴对称 | |
| C. | π键是由两个p电子“肩并肩”重叠形成的 | |
| D. | σ键 都是由两个p轨道“头碰头”重叠形成的 |
19.下列混合物能用分液法分离的是( )
| A. | 乙醇与乙酸 | B. | 苯和硝基苯 | ||
| C. | 乙酸乙酯和Na2CO3溶液 | D. | 乙醛与水 |




 在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算:
在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算: