题目内容
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是 
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为: X(g)+Y(g) Z(g) Z(g) |
C
解析试题分析:反应开始到10s时,Z的物质的量增加了1.58mol,则用Z表示的反应速率为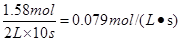 ,A不正确;反应开始到10s,X的物质的量浓度减少了(1.20mol-0.41mol)÷2L=0.395mol/L,B不正确;反应开始到10s时,Y的物质的量减少了0.79mol,所以其转化率是
,A不正确;反应开始到10s,X的物质的量浓度减少了(1.20mol-0.41mol)÷2L=0.395mol/L,B不正确;反应开始到10s时,Y的物质的量减少了0.79mol,所以其转化率是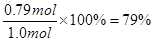 ,C正确。D不正确,方程式应该是:X(g)+Y (g)
,C正确。D不正确,方程式应该是:X(g)+Y (g) 2Z(g),答案选C。
2Z(g),答案选C。
考点:考查反应速率、转化率的减少以及方程式的判断,该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应速率的含义以及表达式,如何结合图像和题意灵活运用即可,有利于培养学生的规范答题能力。

可逆反应:A+3B 2C+2D(各物质均为气体),在不同情况下测得有下列4 种
2C+2D(各物质均为气体),在不同情况下测得有下列4 种
反应速率,其中反应最快的是
| A.vD=0.4 mol / (L·s) | B.v C=0.5 mol / (L·s) |
| C.v B=0.6 mol / (L·s) | D.v A=0.15 mol / (L·s) |
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+H2O(g) CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
| A.充入氦气 | B.分离除乙醇 | C.增大压强 | D.升高温度 |
下列有关化学反应速率的说法正确的是
| A.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
| A.平衡向正反应方向移动 | B.x+y<z |
| C.C的体积分数降低 | D.B的转化率增大 |
下列事实中,不能用勒夏特列原理解释的是
| A.密闭、低温是存放氨水的必要条件 |
| B.实验室常用排饱和食盐水法收集氯气 |
| C.硝酸工业生产中,使用过量空气以提高NH3的利用率 |
| D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①③④⑤ | B.①②④⑤ | C.①②③④ | D.①②④ |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.气体的平均相对分子质量 | D.B的物质的量浓度 |
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g) Ni(CO)4(g) ΔH < 0
Ni(CO)4(g) ΔH < 0
反应二:Ni(CO)4(g) Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0
下列说法错误的是
| A.对于反应一,适当增大压强,有利于Ni(CO)4的生成 |
| B.提纯过程中,CO气体可循环使用 |
| C.升高温度,反应一的反应速率减小,反应二的速率增大 |
| D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高 |