题目内容
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.气体的平均相对分子质量 | D.B的物质的量浓度 |
A
解析试题分析:A、该反应前后气体体积不变,所以混合气体的压强始终不变,错误;B、混合气体质量未平衡时会改变,所以平衡后混合气体密度不变,正确;C、混合气体质量未平衡时会改变,所以平均相对分子质量不变说明已达平衡,正确;D、B的浓度不变则达到平衡,正确。
考点:考查了化学平衡的标志。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是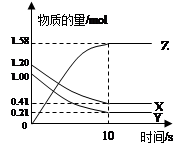
A.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
| D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是 
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为: X(g)+Y(g) Z(g) Z(g) |
活化分子是衡量化学反应速率快慢的重要依据,下列说法中不正确的是( )
| A.增大压强,可使活化分子数增多,反应速率加快 |
| B.增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C.能够发生有效碰撞的分子一定是活化分子 |
| D.升高温度,使单位体积内活化分子百分数大大增加 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2(g)  N2O4(g)△H<0 N2O4(g)△H<0 |
B.3O2(g) 2O3(g)△H>0 2O3(g)△H>0 |
C.H2(g)+I2(g) 2 H I(g)△H<0 2 H I(g)△H<0 |
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g)△H>0 NH3(g)+H2O(g)+CO2(g)△H>0 |


 ,5min内氨的质量增加了1.7g,则反应速率为( )
,5min内氨的质量增加了1.7g,则反应速率为( )



 C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )