题目内容
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+H2O(g) CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
| A.充入氦气 | B.分离除乙醇 | C.增大压强 | D.升高温度 |
C
解析试题分析:该反应是体积减小的放热的可逆反应,要使反应速率加快,同时乙烯的转化率提高,方法有升高温度,增大有气体参加的反应的压强等;提高乙烯的转化率,使反应向着正反应方向移动。A、充入氦气,如果容器容积不变,则反应速率不变。如果保持越强和温度不变,则容器容积增大,减小压强,根据勒夏特列原理,平衡向着逆向移动,乙烯转化率减小,且反应速率降低,故A错误;B、分离出乙醇,反应向着正向移动,乙烯转化率增大,但是反应速率降低,故B错误;C、由于增大了压强,反应速率增大,化学平衡向着正向移动,乙烯转化率增大,故C正确;D、升高了温度,反应速率增大,但是该反应是放热反应,平衡向着逆向移动,乙烯的转化率减小,故D错误,答案选C。
考点:考查外界条件对反应速率和平衡状态的影响

恒容容器中反应:A(g)+3B(g) 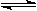 2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是
①体系的压强不再改变 ②混合气体的平均相对分子质量不再改变 ③各组分的浓度不再改变 ④混合气体的密度不变 ⑤反应速率vA: vB: vC: vD=1:3:2:3 ⑥单位时间内1 mol A断键反应,同时2 mol C也断键反应
| A.②③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.①②③⑥ |
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
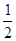 N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时减小压强 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是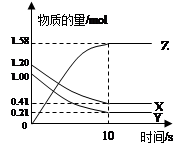
A.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
| D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
已知N2(g)+3H2(g) 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
| A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ |
| B.H2的百分含量相同 |
| C.N2的转化率:平衡I<平衡Ⅱ |
| D.反应放出的热量:QⅠ=QⅡ<92.3kJ |
在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.化学计量数关系:a>b |
甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是
| A.脱氢反应的△H<0 |
| B.600K时,Y点甲醇的υ(正) <υ(逆) |
| C.从Y点到Z点可通过增大压强 |
| D.在t1K时,该反应的平衡常数为8.1mol·L-1 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是 
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为: X(g)+Y(g) Z(g) Z(g) |
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2(g)  N2O4(g)△H<0 N2O4(g)△H<0 |
B.3O2(g) 2O3(g)△H>0 2O3(g)△H>0 |
C.H2(g)+I2(g) 2 H I(g)△H<0 2 H I(g)△H<0 |
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g)△H>0 NH3(g)+H2O(g)+CO2(g)△H>0 |