题目内容
可逆反应:A+3B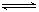 2C+2D(各物质均为气体),在不同情况下测得有下列4 种
2C+2D(各物质均为气体),在不同情况下测得有下列4 种
反应速率,其中反应最快的是
| A.vD=0.4 mol / (L·s) | B.v C=0.5 mol / (L·s) |
| C.v B=0.6 mol / (L·s) | D.v A=0.15 mol / (L·s) |
B
解析试题分析:根据反应速率之比等于化学计量数之比,可将各种物质转化成A,以此可比较反应速率大小。
A选项v(A)=1/2v(D)=0.2 mol?L-1?s-1 。B选项v(A)=1/2v(C)=0.2 5mol?L-1?s-1。C选项v(A)
=1/3v(B)=0.2 mol?L-1?s-1。D选项v(A)=0.15 mol?L-1?s-1。故反应速率B选项。
考点:化学反应速率计算

在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氨气的平均速率:ν(NH3)=0.3mol/(L·s),则2s末NH3的浓度为
| A.0.60mol/L | B.0.50mol/L | C.0.45mol/L | D.0.55mol/L |
恒容容器中反应:A(g)+3B(g) 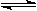 2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是
①体系的压强不再改变 ②混合气体的平均相对分子质量不再改变 ③各组分的浓度不再改变 ④混合气体的密度不变 ⑤反应速率vA: vB: vC: vD=1:3:2:3 ⑥单位时间内1 mol A断键反应,同时2 mol C也断键反应
| A.②③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.①②③⑥ |
工业生产苯乙烯是利用乙苯的脱氢反应:
下列说法错误的是
| A.该反应中生成物的总能量高于反应物 |
| B.增大压强反应物活化分子百分数不变 |
| C.升高温度可以提高原料乙苯的转化率 |
| D.不断分离出苯乙烯可加快反应速率 |
下列关于判断过程的方向的说法正确的是 ( )
| A.所有自发进行的化学反应都是放热反应 |
| B.判断化学反应能否自发进行,必须综合考虑反应的焓变和熵变 |
| C.自发反应一定是熵增大,非自发反应一定是熵减小的反应 |
| D.同一物质的固、液、气三种状态中固体的熵值最大 |
COCl2(g)  CO(g) + Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2 分解率的是
CO(g) + Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2 分解率的是
| A.①④⑥ | B.①②④ | C.②③⑥ | D.③⑤⑥ |
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
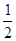 N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时减小压强 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是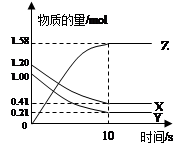
A.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
| D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是 
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为: X(g)+Y(g) Z(g) Z(g) |