题目内容
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①③④⑤ | B.①②④⑤ | C.①②③④ | D.①②④ |
B
解析试题分析:增大盐酸与锌粒的反应速率,可通过外界条件对化学反应速率的影响来考虑,可增大氢离子浓度、升高温度,增大固体的表面积或通过原电池反应等因素来实现。
①温度升高,反应速率增大,故①正确;②改用100mL3mol?L-1盐酸,反应物的浓度增大,反应速率增大,故②正确;③多用300mL 1mol/L盐酸,反应物的量增多,但浓度不变,反应速率不变,故③错误;④用等量锌粉代替锌粒,固体的表面积增大,反应速率增大,因此选项④正确;⑤滴入少量CuSO4溶液,锌可以置换出铜,从而构成铜锌原电池,加快反应速率,⑤正确,答案选B。
考点:考查外界条件对化学反应速率的影响。该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,针对性强。平时学习中注意相关基础知识的积累和总结即可,有助于调动学生的学习兴趣和学习积极性。

在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
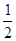 N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
N2(g)+CO2(g);ΔH=-373.2kJ·mol-1
达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时减小压强 |
甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是
| A.脱氢反应的△H<0 |
| B.600K时,Y点甲醇的υ(正) <υ(逆) |
| C.从Y点到Z点可通过增大压强 |
| D.在t1K时,该反应的平衡常数为8.1mol·L-1 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是 
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为: X(g)+Y(g) Z(g) Z(g) |
对于密闭容器中的可逆反应:4L(g)  2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
| A.气体混合物的平均相对分子质量 |
| B.气体混合物的总物质的量浓度 |
| C.L在气体混合物的体积分数 |
| D.气体混合物的密度 |
活化分子是衡量化学反应速率快慢的重要依据,下列说法中不正确的是( )
| A.增大压强,可使活化分子数增多,反应速率加快 |
| B.增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C.能够发生有效碰撞的分子一定是活化分子 |
| D.升高温度,使单位体积内活化分子百分数大大增加 |
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2(g)  N2O4(g)△H<0 N2O4(g)△H<0 |
B.3O2(g) 2O3(g)△H>0 2O3(g)△H>0 |
C.H2(g)+I2(g) 2 H I(g)△H<0 2 H I(g)△H<0 |
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g)△H>0 NH3(g)+H2O(g)+CO2(g)△H>0 |
在密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
| A.上述反应的△H>0 |
| B.压强P1>P2>P3>P4 |
| C.1100℃该反应的平衡常数为64mol2·L-1 |
| D.压强为P4时,在Y点:v(正)<v(逆) |