题目内容
15.与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是( )| A. | Na2S | B. | CCl4 | C. | KCl | D. | Na2O |
分析 根据元素周期表,与Ne核外电子排布相同的离子有,阴离子有N3-、O2-、F-等,阳离子有Na+、Mg2+AI3+;与Ar核外电子排布相同的离子阴离子P3-、S2-、CI-等,阳离子K+、Ca2+.
解答 解:A、Na2S中的Na+与Ne核外电子排布相同、S2-离子结构与Ar核外电子排布相同,故A正确;
B、CCl4是共价化合物,不存在离子,故B错误;
C、氯化钾中,氯离子的核外电子排布与Ar的核外电子排布相同,钾离子与Ar的核外电子排布也相同,故C错误;
D、氧化钠中,氧离子的核外电子排布与Ne的核外电子排布相同,钠离子与Ne的核外电子排布也相同,故D错误;
故选A.
点评 本题考查了原子结构,形成离子的结构,关键是掌握元素在周期表中的位置及结构,难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
6.下列物质的电子式书写正确的是( )
| A. | NaCl  | B. | H2S  | C. | Na2O  | D. | NH4I  |
3.L-T 5种短周期元素的信息如下表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 热稳定性:H2T<H2R | |
| D. | L2+与R2-的核外电子数相等 |
20.Te(碲)元素位于是第5周期ⅥA族,根据同族元素的性质推断,碲不可能具有的性质是( )
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
7.在铜制品上的铝质铆钉,在潮湿空气中容易腐蚀的原因是( )
| A. | 形成原电池时,铝作阴极极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铝经导线流向铜 | |
| D. | 铝铆钉发生了电化学腐蚀 |
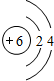 ;
;
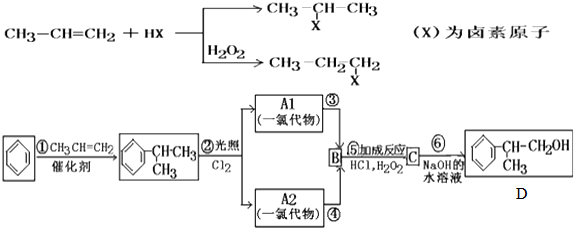
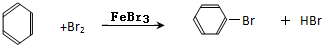 .
.
 B.
B. C.
C.
 C的结构简式:
C的结构简式: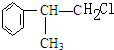 .
. +NaCl.
+NaCl.