题目内容
11.下列所熟悉的物质:①O2 ②NaBr③H2SO4④Na2CO3⑤Na2O2⑥NaHSO4⑦NH4Cl⑧金刚石
(1)这些物质中,只含共价键的是①③⑧;只含离子键的是②;属于共价化合物的是③;属于离子化合物的是②④⑤⑥⑦.
(2)将NaHSO4溶于水破坏了NaHSO4中的离子键和共价键;将NaHSO4熔化,破坏了NaHSO4中的离子 键.
分析 (1)一般来说,活泼金属与非金属形成离子键、非金属之间形成共价键,含离子键的一定为离子化合物,共价化合物中只含共价键;
(2)NaHSO4溶于水发生电离生成钠离子、氢离子、硫酸根离子;NaHSO4熔化电离出钠离子与硫酸氢根离子.
解答 解:(1)①O2中只含非极性共价键,为单质;
②NaBr中含离子键,为离子化合物;
③H2SO4中含共价键,为共价化合物;
④Na2CO3含离子键和共价键,为离子化合物;
⑤Na2O2含离子键和共价键,为离子化合物;
⑥NaHSO4含离子键和共价键,为离子化合物;
⑦NH4Cl含离子键和共价键,为离子化合物;
⑧金刚石中只含非极性共价键,为单质,
这些物质中,只含共价键的是①③⑧;只含离子键的是②;属于共价化合物的是③;属于离子化合物的是②④⑤⑥⑦,故答案为:①③⑧;②;③;②④⑤⑥⑦;(2)NaHSO4溶于水发生电离生成钠离子、氢离子、硫酸根离子,则破坏离子键和共价键;NaHSO4熔化电离出钠离子与硫酸氢根离子,破坏离子键,
故答案为:离子键和共价;离子.
点评 本题考查化学键,为高频考点,把握化学键的形成、判断的一般规律及常见物质中的化学键为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1. 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )| A. | 分子中5个R-Cl键键能不都相同 | |
| B. | 键角(Cl-R-Cl)有90°、120、180°几种 | |
| C. | RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3 | |
| D. | 每个原子都达到8电子稳定结构 |
2.向醋酸溶液中滴加NaOH溶液,则( )
| A. | 醋酸的电离平衡向左移动 | B. | 溶液的pH减小 | ||
| C. | 醋酸根离子的物质的量减小 | D. | 醋酸的浓度减小 |
19.下列互为同位素的是( )
| A. | H2 D2 | B. | 14N 14C | C. | 16O 17O | D. | 金刚石 石墨 |
6.下列物质的电子式书写正确的是( )
| A. | NaCl 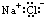 | B. | H2S 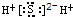 | C. | Na2O 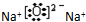 | D. | NH4I 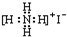 |
3.L-T 5种短周期元素的信息如下表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 热稳定性:H2T<H2R | |
| D. | L2+与R2-的核外电子数相等 |
20.Te(碲)元素位于是第5周期ⅥA族,根据同族元素的性质推断,碲不可能具有的性质是( )
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
1.下列关于周期表中有关族的叙述,正确的是( )
| A. | I A族元素又称为碱金属元素 | |
| B. | 副族和Ⅷ族中的元素均为过渡元素 | |
| C. | 族的序数都等于该族元素原子的最外层电子数 | |
| D. | 元素周期表中每个纵列为一族,共有18个族 |
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.