题目内容
13.下列关于氯气的说法不正确的是( )| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 将鲜花放入盛有氯气的集气瓶中,鲜花褪色,说明Cl2具有漂白性 | |
| C. | 可以用浓硫酸除去氯气中的水蒸气 | |
| D. | 氢气在氯气中燃烧产生苍白色火焰瓶口有白雾 |
分析 A.新制氯水中含有次氯酸和盐酸,溶液呈酸性,次氯酸具有漂白性;
B.氯气和水反应生成次氯酸,次氯酸具有漂白性;
C.浓硫酸具有吸水性,且和氯气不反应;
D.在点燃条件下,氢气能在氯气中燃烧生成苍白色火焰,生成的HCl遇水蒸气形成盐酸小液滴.
解答 解:A.新制氯水中含有次氯酸和盐酸,溶液呈酸性,次氯酸具有漂白性,所以新制氯水可使紫色石蕊试液先变红后褪色,故A正确;
B.氯气和水反应生成次氯酸,次氯酸具有漂白性,氯气没有漂白性,故B错误;
C.浓硫酸具有吸水性,且和氯气不反应,所以浓硫酸能吸收氯气中的水蒸气,故C正确;
D.在点燃条件下,氢气能在氯气中燃烧生成苍白色火焰,生成的HCl遇水蒸气形成盐酸小液滴,所以氢气在氯气中燃烧产生苍白色火焰瓶口有白雾,故D正确;
故选B.
点评 本题考查氯气和次氯酸的性质,氯气具有强氧化性但没有漂白性,次氯酸有漂白性,但次氯酸是弱酸,题目难度不大.

练习册系列答案
相关题目
3.L-T 5种短周期元素的信息如下表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 热稳定性:H2T<H2R | |
| D. | L2+与R2-的核外电子数相等 |
1.下列关于周期表中有关族的叙述,正确的是( )
| A. | I A族元素又称为碱金属元素 | |
| B. | 副族和Ⅷ族中的元素均为过渡元素 | |
| C. | 族的序数都等于该族元素原子的最外层电子数 | |
| D. | 元素周期表中每个纵列为一族,共有18个族 |
8.实验室用锌粒与2mol•L-1硫酸溶液制取氢气,下列措施能增大化学反应速率的是( )
| A. | 加入CH3COONa溶液 | B. | 改用3 mol•L-1盐酸 | ||
| C. | 用锌粉代替锌粒 | D. | 加入少量铜粉 |
18.有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
2.下列物质中一定互为同系物的是( )
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤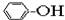 ⑥
⑥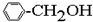 ⑦
⑦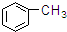 ⑧
⑧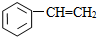
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤
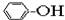 ⑥
⑥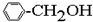 ⑦
⑦ ⑧
⑧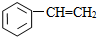
| A. | ①③ | B. | ②④ | C. | ⑤⑥ | D. | ⑦⑧ |

 B.
B. C.
C.
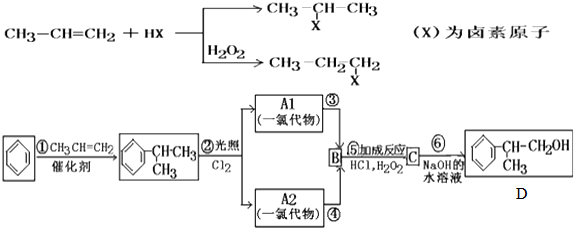
 C的结构简式:
C的结构简式: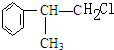 .
. +NaCl.
+NaCl.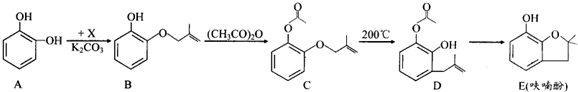
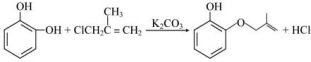 ;
;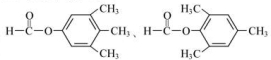 ;
;