题目内容
【题目】防止水体污染,改善水质,最根本的措施是控制工业废水和生活污水的排放。有一种工业废水,已知其中含有大量的Fe2+和SO42-,少量的Ag+和Na+,以及部分污泥。某校化学兴趣小组同学通过下列操作过程,回收物质,处理废水。

根据上述操作过程,回答下列问题:
(1)在实验室进行Ⅰ操作时,需要的主要玻璃仪器有_______________。
(2)操作Ⅱ的名称是_____________。
(3)向溶液A中需要加入过量X,X是________________,发生反应的离子方程式为___________。
(4)上述操作回收到的固体B是________________,晶体是_________________。(两空均写名称)
【答案】漏斗 烧杯 玻璃棒 蒸发结晶 Fe Fe+2Ag+=Fe2++2Ag 银 硫酸亚铁晶体
【解析】
废水含有大量的Fe2+和SO42-,少量的Ag+和Na+,在废水中加入过量Fe可置换出Ag,则固体A为Ag和Fe的混合物,再加入硫酸可得硫酸亚铁溶液,固体B为Ag。
(1)根据以上分析,Ⅰ操作为过滤,需要的玻璃仪器有漏斗、烧杯、玻璃棒;
(2)溶液B为硫酸亚铁溶液,要得到硫酸亚铁晶体,应进行蒸发结晶操作,答案为:蒸发结晶;
(3)由以上分析可知X为Fe,发生反应为Fe+2Ag+=Fe2++2Ag;
(4)固体B为银,溶液B为硫酸亚铁,可得到硫酸亚铁晶体。

【题目】如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上
没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是
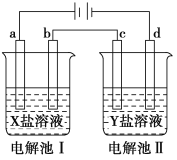
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
A. A B. B C. C D. D


