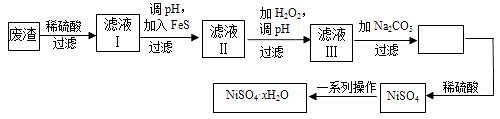
题目内容
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO、Y、NO |
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为______________________________________________
(3)丁组实验在酸性条件下发生反应的离子方程式是______________________________。
【答案】(1) NH,SO;(2) Cl-,取少量废水试样,滴加足量的Ba(NO3)2溶液,静置;取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-;若无白色沉淀产生,则不存在Cl- ;( 3 ) 6I-+2NO+8H+===3I2+2NO↑+4H2O 。
【解析】
试题分析:甲和溴水不反应,说明不含SO32-,乙和酸化的BaCl2溶液产生白色沉淀,说明含有SO42-,即Y为SO4-,丙和NaOH溶液并加热反应产生使红色石蕊试纸变蓝的气体,则含有NH4+,丁中溶液显蓝色,说明含有NO3-,因为NO3-在H+条件下具有强氧化性,把I-氧化成I2,淀粉溶液变蓝,(1)根据上述推断,X为NH4+,Y为SO42-;(2)不能确定的阴离子为Cl-,检验Cl-用硝酸酸化的硝酸银进行检验,但首先除去SO42-,因此操作:取少量废水试样,滴加足量的Ba(NO3)2溶液,静置;取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-;若无白色沉淀产生,则不存在Cl- ;(3)6I-+2NO+8H+===3I2+2NO↑+4H2O 。