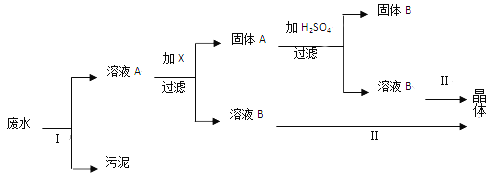
��Ŀ����
����Ŀ��ijͬѧ����240mL 1.00mol��L��1 Na2CO3��Һ����ش��й����⡣
��1������ʱ������4��������˳���ǣ�����ű�ʾ��ÿ������ֻ����һ�Σ�____��
�ٽ�����ȴ��Na2CO3��Һ�ز�����ע��____�У�
������ƽȷ��ȡ____g Na2CO3���壬������������ˮ��Լ30mL�����ò������������裬ʹ�����ܽ⣻
������ƿ�����ߵ�ҡ�ȣ�
�ܼ���������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�____��������____��ˮ����Һ��Һ����̶������С�
��2���������������Ƶ�Na2CO3��Һ��Ũ��____��ѡ��������������������1.00mol��L-1��������____��
���𰸡��ڢ٢ܢ� 250mL����ƿ 26.5 �̶��� ��ͷ�ι� ���� ��ʵ��©��ϴ�Ӳ��������²���������ģ����ʵ����ʵ���ƫС������c=![]() ��֪������������Һ��Ũ��С��1.00molL-1��
��֪������������Һ��Ũ��С��1.00molL-1��
��������
��1���ٽ�����ȴ��Na2CO3��Һ�ز�����ע��250ml����ƿ�У�
������240mL 1.00molL-1 Na2CO3��Һ��Ҫ��250mL������ƿ����Ҫ����̼���Ƶ�����m=1mol/L��0.25L��106g/mol=26.5g��
�ܼ���������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶ȿ̶��ߴ������ý�ͷ�ιܼ�ˮ����Һ��Һ����̶������У�
˳��Ϊ���ڢ٢ܢۣ�
��2���������������Ƶ�Na2CO3��Һ��Ũ�Ȳ���1.00mol��L-1����ʵ��©��ϴ�Ӳ��������²���������ģ����ʵ����ʵ���ƫС������c=![]() ��֪������������Һ��Ũ��С��1.00molL-1��
��֪������������Һ��Ũ��С��1.00molL-1��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�����Ŀ������������Һ��A������B��ϡ����C��NaOH��ҺD��Ba(OH)2��Һ����Щ��Һ�������ʵ���Ũ�Ⱦ�Ϊ0.3mol/L��������Һȡ��������жϵõ�����Һ�д��ڵ���Ҫ���Ӽ���Ũ�ȣ����߸����������ӵ�������ƶ�������Һ��������Щ��Һ������������Ȼ�ϵĽ��(������Һ��Ϻ������仯)
��Һȡ����� | ��Һ�д��ڵ���Ҫ���Ӽ���Ũ�� |
��ҺA��B�������2:1��� | ��____________ |
��____________ | Na+��Cl�����ʵ���Ũ�Ⱦ�Ϊ0.15 mol/L |
����������ҺB��C | ��____________ |
��ҺA��D�������2:1��� | ��____________ |
��____________ | Ba2+���ʵ���Ũ��Ϊ0.1 mol/L��OH�����ʵ���Ũ��Ϊ0.2 mol/L |