题目内容
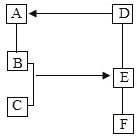
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
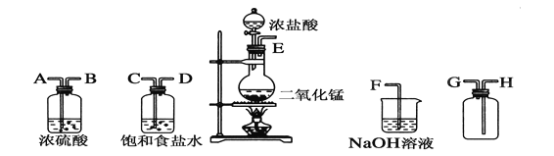
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。
②NaOH溶液中发生的反应:__________________________________________ 。
【答案】E C D A B H G F 除去氯气中的HCl杂质 吸收过量的氯气 MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 2NaOH+Cl2=NaCl+NaClO+H2O
MnCl2+2H2O+Cl2↑ 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
(1)二氧化锰在加热的条件下氧化浓盐酸生成氯气,由于浓盐酸易挥发,因此生成的氯气中含有氯化氢杂质,所以需要先通过盛有饱和食盐水的洗气瓶除去氯气中的氯化氢杂质;由于要收集干燥的氯气,所以还需要再次通过浓硫酸干燥氯气;氯气的密度大于空气,因此用向上排空气法收集,即长口进,短口出;又因为氯气有毒,所以最后还需要进行尾气处理,即将尾气通入到氢氧化钠溶液中吸收剩余的氯气,以防止污染空气,因此正确的连接顺序是E、C、D、A、B、H、G、F。
(2)根据以上分析可知,饱和食盐水的作用是除去氯气中的HCl杂质;NaOH溶液的作用是吸收过量的氯气。
(3)①实验室制取氯气的方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
②氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。

练习册系列答案
相关题目