题目内容
10.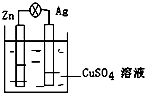 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+,锌片上观察到的现象为Zn片逐渐溶解银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu,银片上观察到的现象是有红色物质析出.
分析 银、锌、硫酸铜溶液构成的原电池中,锌易失电子发生氧化反应而作负极,银作正极,正极上铜离子得电子发生还原反应生成铜,据此分析解答.
解答 解:银、锌、硫酸铜溶液构成的原电池中,锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,导致锌逐渐溶解,电极反应式为Zn-2e-═Zn2+,银作正极,正极上铜了在得电子发生还原反应而析出铜单质,电极反应式为Cu2++2e-═Cu,所以看到的现象是有红色物质析出,
故答案为:负;氧化;Zn-2e-═Zn2+;Zn片逐渐溶解;正;还原;Cu2++2e-═Cu;有红色物质析出.
点评 本题考查了原电池原理,明确原电池中正负极上得失电子及发生的反应即可解答,难度不大.

练习册系列答案
相关题目
20. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )| A. | 1mol该物质完全燃烧最多能消耗10.5mol的氧气 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 1mol该物质最多能与4 molH2加成 | |
| D. | 分子式为C10H9O3 |
5.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
2.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好一次通过盛有以下哪种试剂的洗气瓶( )
| A. | 澄清石灰水,浓硫酸 | B. | 酸性高锰酸钾溶液,浓硫酸 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓硫酸,酸性高锰酸钾溶液 |
19.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3CHO→C2H5OH | B. | C2H5Cl→CH2=CH2 | ||
| C. | C3H7Br→C3H7OH | D. | CH3COOH→CH3COOC2H5 |
 ,名称是环己烷.
,名称是环己烷.