题目内容
9.吸热反应N2(g)+O2 (g)?2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入2.94×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?否
(2)若非化学平衡状态,反应将向哪个方向进行?逆向移动.
分析 (1)Qc=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$=$\frac{(2.94×1{0}^{-4})^{2}}{2.50×1{0}^{-2}×4.0×1{0}^{-3}}$=8.6×10-4>K,所以初始状态不是化学平衡状态;
(2)因为Qc>K,所以平衡逆向移动.
解答 解:(1)Qc=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$=$\frac{(2.94×1{0}^{-4})^{2}}{2.50×1{0}^{-2}×4.0×1{0}^{-3}}$=8.6×10-4>K,所以初始状态不是化学平衡状态;故答案为:否;
(2)因为Qc>K,所以平衡逆向移动,故答案为:逆向移动.
点评 本题考查了平衡常数含义和表达式的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
19.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3CHO→C2H5OH | B. | C2H5Cl→CH2=CH2 | ||
| C. | C3H7Br→C3H7OH | D. | CH3COOH→CH3COOC2H5 |
17.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述不正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A. | 阳极发生氧化反应,其电极反应式主要是:Ni-2e-=Ni2+ | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加不相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+、Ni2+和Zn2+ | |
| D. | 电解后,电解槽底部的阳极泥中只有Pt |
4.下列说法不正确的是( )
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |
14.下列反应的离子方程式中,可以用H++OH-=H2O 表示的是( )
| A. | 醋酸与KOH溶液 | B. | 氢氧化铜与盐酸 | ||
| C. | NaHSO4溶液与氨水 | D. | 硝酸与Ba(OH)2溶液 |
18.某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物.
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
19.下列粒子(分子或离子)均含有18个电子:
请回答下列问题:
(1)A的元素符号是K,B2-的结构示意图是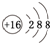 .
.
(2)C与D混合,发生反应的化学方程式为F2+2HCl═2HF+Cl2.
(3)E的电子式是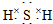 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2.
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
(1)A的元素符号是K,B2-的结构示意图是
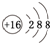 .
.(2)C与D混合,发生反应的化学方程式为F2+2HCl═2HF+Cl2.
(3)E的电子式是
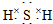 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2. 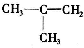 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2. ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.