题目内容
【题目】一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列说法正确的是( )
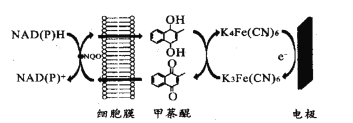
A.图中所示电极为阳极,其电极反应式为K4Fe(CN6)-e-=K3Fe(CN)6
B.甲荼醌在阴极发生氧化反应
C.工作时K+向图中所示电极移动
D.NAD(P)H转化为NAD(P)+的过程失去电子
【答案】D
【解析】
A. 根据图示可知K4Fe(CN6)在电极表面失电子生成K3Fe(CN)6,故图示电极为阳极,其电极方程式为K4Fe(CN6)-e-=K3Fe(CN)6+K+,A项错误;
B. 甲萘醌应在阴极发生还原反应,B项错误;
C. 工作时在电解池中阳离子应向阴极移动,C项错误;
D. 根据图示,该过程NAD(P)H被甲萘醌氧化,即失去电子,D项正确;
答案选D。

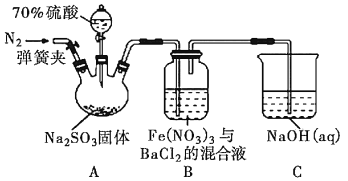
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。
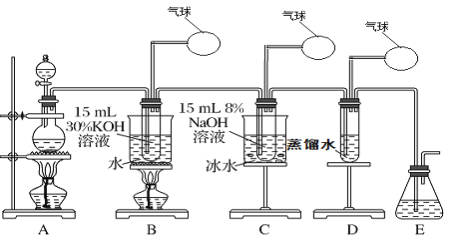
实验Ⅰ.制取氯酸钾(KClO3)、次氯酸钠、氯水
(1)写出装置A实验室制取Cl2的化学反应方程式_________________________
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、________、________。
(3)写出B中制备氯酸钾(KClO3)的方程式____________________
(4)装置C中反应需要在冰水浴中进行,其原因是_____________________________
资料:SO2是一种酸性氧化物,与CO2相似,2NaOH(过量)+SO2=Na2SO3+H2O ,SO32-是还原性很强的离子,在溶液中与氧化性强的离子不能大量共存,易被氧化成SO42—。
实验Ⅱ.尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和![]()
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)。
①提出合理假设:
假设1:只存在![]() ;
;
假设2:既不存在![]() 也不存在ClO-;
也不存在ClO-;
假设3:______________________________。
②设计实验方案,进行实验。请在表中写出实验步骤以及预期现象和结论。
限选实验试剂:3mol·L-1 H2SO4、1mol·L-1 NaOH溶液、0.01mol·L-1酸性KMnO4溶液、淀粉、KI溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
步骤3:____________________________________ | __________________________________ |