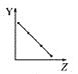题目内容
【题目】根据如图所示的反应判断下列说法中错误的是

A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
【答案】D
【解析】
A.因为碳酸钙受热分解是吸热反应,所以CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量,A项正确,不符合题意;
B.吸热反应,焓变大于零,B项正确,不符合题意;
C.在CaCO3中,Ca2+和CO32-之间存在离子键,CO32-中,C与O之间存在共价键,故反应中有离子键断裂也有共价键断裂,旧化学键断裂吸收能量,新化学键形成放出能量,C项正确,不符合题意;
D.需要加热才发生的反应不一定为吸热反应,如碳的燃烧需要加热,但该反应是放热反应,D错误,符合题意;
本题答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目