题目内容
【题目】标出下列反应电子转移的方向和总数:
2Fe(NO3)3 + 16NaOH + 3Cl2 → 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O________________
(1)反应中______元素被氧化, 还原剂是__________, 还原产物是_______,发生还原反应的物质是_________
(2)若反应中转移了0.2 mol电子,则消耗了_______L Cl2(标准状况)。
【答案】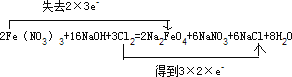 +3价的铁 Fe(NO3)3 NaCl Cl2 2.24
+3价的铁 Fe(NO3)3 NaCl Cl2 2.24
【解析】
Fe元素的化合价由+3价升高为+6价,Cl元素的化合价应为0降低为-1价,由质量守恒定律及电子守恒可知配平后化学反应为2Fe(NO3)3 + 16NaOH + 3Cl2 = 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O,用双线桥法表示出电子转移的方向和数目为 ;
;
(1)该反应中Fe元素化合价由+3价变为+6价,Cl元素化合价由0价变为﹣1价,该反应中Fe元素化合价升高被氧化,还原剂是Fe(NO3)3,还原产物是NaCl,发生还原反应的物质是Cl2;
(2)若反应中转移了0.2 mol电子,根据反应2Fe(NO3)3 + 16NaOH + 3Cl2 = 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O,则消耗了0.2 mol 氯气,标准条件为2.24L Cl2。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目