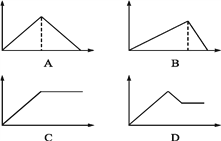
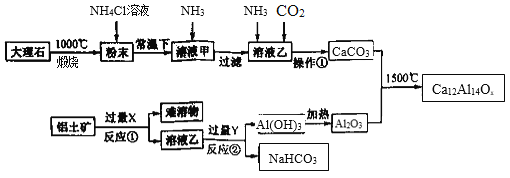
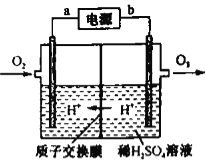
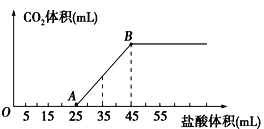
题目内容
【题目】碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快速平衡)
2I(g)(快速平衡)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列说法错误的是( )
A.升高温度,第一步向右进行的程度变大
B.第二步的活化能大于第三步的活化能
C.总反应为2N2O![]() 2N2+O2
2N2+O2
D.c[IO(g)]对总反应速率的影响大于c[I(g)]
【答案】D
【解析】
A.化学键断裂为吸热反应,所以升高温度,第一步向右进行的程度变大,故A正确;
B.活化能越大反应速率越慢,第二步为慢反应,所以第二步活化能大于第三步活化能,故B正确;
C.三步反应相加可得总反应为2N2O![]() 2N2+O2,碘蒸气为催化剂,故C正确;
2N2+O2,碘蒸气为催化剂,故C正确;
D.决定总反应速率的步骤为慢反应,第二步为慢反应,所以c[I(g)]对总反应速率的影响更大,故D错误;
故答案为D。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目