题目内容
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
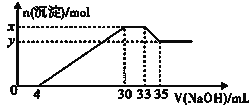
A.x-y=0.01molB.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/LD.原溶液中n(Mg2+):n(Al3+)=5:1
【答案】B
【解析】
向溶液中滴加NaOH溶液,并结合图象可知,0~4mL时发生酸碱中和,4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,30mL~33mL发生NH4+与OH-的反应,33mL~35mL发生氢氧化铝的溶解反应,然后利用离子反应方程式来计算解答。
A.由图及离子反应可知x-y的值即为Al(OH)3的物质的量,设Al(OH)3的物质的量为n,Al(OH)3+OH-=AlO2-+2H2O,n[Al(OH)3]=n(OH-)=5mol/L×(35-33)mL×0.001L/mL=0.01mol,即x-y=0.01mol,A正确;
B.由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在,根据元素守恒可知此时溶液中n(Cl-)=n(Na+)=n(NaOH)=5mol/L×0.033L=0.165mol,则原溶液中Cl-的物质的量浓度c(Cl-)=0.165mol÷0.2L=0.0825mol/L,B错误;
C.由图0~4mL时发生H++OH-=H2O,则H+的物质的量n(H+)=4mL×0.001L/mL×5mol/L=0.02mol,所以H+的物质的量浓度c(H+)=0.02mol÷0.2L=0.1mol/L,C正确;
D.由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,则Al3++3OH-=Al(OH)3↓,n(Al3+)=n[Al(OH)3]= 0.01mol,则形成Al(OH)3沉淀消耗OH-的物质的量为0.03mol,Mg2+、Al3+结合OH-生成沉淀共消耗OH-的物质的量为5mol/L×(30-4)mL×0.001L/mL=0.13mol,则Mg2+形成沉淀消耗的OH-离子的物质的量为0.13mol-0.03mol=0.1mol,所以根据Mg2++2OH-=Mg(OH)2↓可知Mg2+的物质的量n(Mg2+)=0.1mol÷2=0.05mol,故原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,D正确;
故合理选项是B。