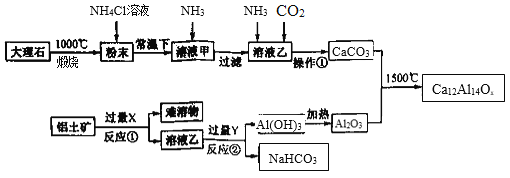
题目内容
【题目】将0.65g锌加入50mL 1mol/L 的稀盐酸中,计算:
(1)标准状况下,生成H2的体积_________;
(2)反应后溶液中Zn2+和H+的物质的量浓度(假设反应后,溶液体积仍为50mL)_________
【答案】0.224L 0.2mol/L ; 0.6mol/L
【解析】
根据Zn+2HCl=ZnCl2+H2反应关系可推知,盐酸的量过量,锌完全反应,反应的产生的氢气的量由锌来决定,从而计算出氢气的体积;根据消耗盐酸的量和已知的总量,可以求出溶液中剩余n(HCl),从而计算出c(H+)。
(1)n(Zn)=![]() =0.01mol,n(HCl)=0.05L×1mol/L=0.05mol;
=0.01mol,n(HCl)=0.05L×1mol/L=0.05mol;

由于0.05mol×1>0.01mol×2,故HCl过量,则H2的量应由Zn的量来计算,n(Zn)=0.01mol,根据化学方程式可知,n(H2)=0.01mol,标况下V(H2)=0.01mol×22.4L/mol=0.224L;
(2)反应中消耗HCl 0.02mol,生成ZnCl2 0.01mol,溶液中剩余HCl 0.03mol,故反应后,溶液中c(Zn2+)=![]() =0.2mol/L,c(H+)=
=0.2mol/L,c(H+)=![]() =0.6mol/L。
=0.6mol/L。

【题目】下表列出了①~111种元素在元素周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |||
一 | ① | ||||||||||
二 | ② | ③ | ④ | ⑤ | |||||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||
四 | |||||||||||
请按要求回答下列问题:
(1)写出元素③形成单质的电子式______________
(2)画这11种元素中,非金属性最强的元素的原子结构示意图________________
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)__________
(4)元素⑨⑩的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)___________
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式____________________
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素强的原因_______________________