题目内容
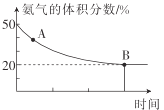
【题目】现有容积均为2 L的甲、乙恒容密闭容器,向甲中充入1.5 mol CO2和3 mol H2,乙中充入2 mol CO2、3 mol H2,一定条件下仅发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是

A.该反应的ΔH>0
B.曲线Ⅱ表示甲容器中CO2的平衡转化率与温度的关系
C.500 K时,该反应的化学平衡常数为200
D.700 K时,若在上述密闭容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,则达到平衡时,H2的体积分数大于![]()
【答案】CD
【解析】
A.随着温度升高,CO2平衡转化率降低,表明温度升高不利于反应正向进行,所以反应为放热反应,该反应的ΔH<0,故A错误;
B.相同温度下,平衡常数不变,曲线Ⅰ中CO2的平衡转化率高,甲和乙相比,相同条件下乙中二氧化碳的浓度大,曲线Ⅰ表示甲容器中CO2的平衡转化率与温度的关系,故B错误;
C.如图所示,曲线Ⅰ代表甲容器的反应,500 K时,CO2的平衡转化率为60%,根据反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),则平衡时n(CO2)= 1.5 mol×(1-60%)=0.6mol,n(H2)=3mol -3×1.5 mol×60%=0.3 mol,n(CH3OH)= n(H2O)=0.9mol,该反应的化学平衡常数为K=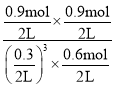 =200,故C正确;
=200,故C正确;
D.如图所示,曲线Ⅱ代表乙容器的反应,700 K时,乙容器中CO2的平衡转化率为20%,根据反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),则平衡时n(CO2)=2mol×(1-20%)=1.6mol,n(H2)=3mol -3×2 mol×20%=1.8 mol,n(CH3OH)= n(H2O)=0.4mol,此时H2的体积分数=![]() =
=![]() ,若在上述密闭容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,此时密闭容器中n(CO2)=2.5mol,n(H2)=3mol,n(CH3OH)= n(H2O)=0.5mol,与原平衡初始相比,氢气的物质的量不变,其他组分增加,相当于增大了密闭容器的压强,平衡正向移动,则达到平衡时,H2的体积分数大于
,若在上述密闭容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,此时密闭容器中n(CO2)=2.5mol,n(H2)=3mol,n(CH3OH)= n(H2O)=0.5mol,与原平衡初始相比,氢气的物质的量不变,其他组分增加,相当于增大了密闭容器的压强,平衡正向移动,则达到平衡时,H2的体积分数大于![]() ,故D正确;
,故D正确;
答案选CD。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
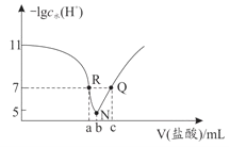
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
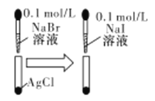
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D