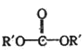
题目内容
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,I是一种萜类化合物,它的合成路线如图所示:
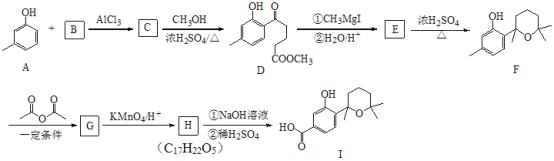
已知:
Ⅰ.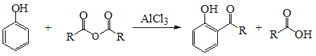
Ⅱ.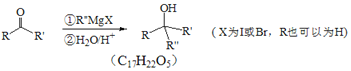
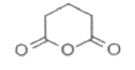
Ⅲ.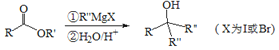
回答下列问题:
(1)A的名称是________,A+B→C的反应类型是___________;
(2)F的分子式_______________,其分子中所含官能团的名称是____________;
(3)H→I第一步的化学反应方程式_________________;
(4)B含有一个环状结构,其结构简式为_________________;
它的同分异构体有多种,其中符合下列条件的有___________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与NaHCO3反应生成CO2
(5)流程中设计F→G这步反应的作用_________________;
(6)F与(CH3CO)2O按物质的量1∶1发生反应生成G的化学方程式为____________;
(7)请以CH3COCH3、CH3CH2MgBr为原料,结合题目所给信息,制备高分子化合物 的流程。
的流程。
例如:原料![]() ……目标化合物
……目标化合物
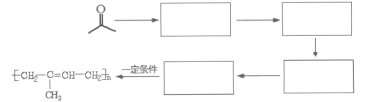
___________________。
【答案】间甲基苯酚或3-甲基苯酚 取代反应 C15H22O2 羟基 醚键 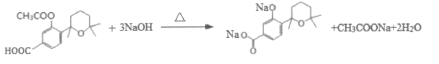
 8 保护酚羟基不被氧化
8 保护酚羟基不被氧化 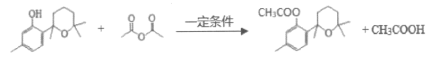

【解析】
由D的结构简式逆推可知C为 ,对比A、C的结构,结合信息I中取代反应,可推知B为
,对比A、C的结构,结合信息I中取代反应,可推知B为 。结合反应条件与信息II、III,可知E为
。结合反应条件与信息II、III,可知E为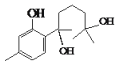 。对比F与I的结构简式,可知从F→I转化中F中甲基被氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,故G为
。对比F与I的结构简式,可知从F→I转化中F中甲基被氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,故G为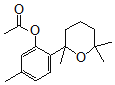 ,H为
,H为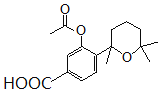 。据此分析解答。
。据此分析解答。
(1)A(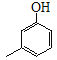 )的名称为间甲基苯酚或3-甲基苯酚;根据上述分析,A+B→C的反应类型是取代反应,故答案为:间甲基苯酚或3-甲基苯酚;取代反应;
)的名称为间甲基苯酚或3-甲基苯酚;根据上述分析,A+B→C的反应类型是取代反应,故答案为:间甲基苯酚或3-甲基苯酚;取代反应;
(2)F(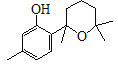 )的分子式为C15H22O2,结构中所含官能团有羟基和醚键,故答案为:羟基、醚键;
)的分子式为C15H22O2,结构中所含官能团有羟基和醚键,故答案为:羟基、醚键;
(3)H( )与氢氧化钠溶液反应时,酯基水解生成的酚羟基也能与氢氧化钠反应,因此H→I第一步的化学反应方程式为
)与氢氧化钠溶液反应时,酯基水解生成的酚羟基也能与氢氧化钠反应,因此H→I第一步的化学反应方程式为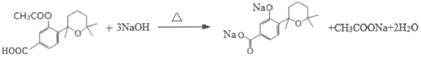 ,故答案为:
,故答案为: ;
;
(4)根据上述分析,B含有一个环状结构,B的结构简式为 ,分子式为C5H6O3,不饱和度=
,分子式为C5H6O3,不饱和度=![]() =3,它的同分异构体有多种,①不含有环状结构,②能发生银镜反应,说明含有醛基,③能与NaHCO3反应生成CO2,说明含有羧基,因此结构中还含有1个碳碳双键,符合条件的结构中含有—C—C=C—,根据定一移二的方法分别确定羧基和醛基的位置,共有8种结构,故答案为:
=3,它的同分异构体有多种,①不含有环状结构,②能发生银镜反应,说明含有醛基,③能与NaHCO3反应生成CO2,说明含有羧基,因此结构中还含有1个碳碳双键,符合条件的结构中含有—C—C=C—,根据定一移二的方法分别确定羧基和醛基的位置,共有8种结构,故答案为: ;8;
;8;
(5)对比F与I的结构简式,可知从F→I转化中F中甲基被氧化为羧基转化为I,由于酚羟基易被氧化,故F与乙酸酐反应生成G,是为保护酚羟基,G中甲基氧化生成H,H发生水解反应、酸化重新引入酚羟基,流程中设计F→G这步反应的作用为,故答案为:保护酚羟基不被氧化;
(6)F( )与(CH3CO)2O按物质的量1:1发生反应生成G的化学方程式为
)与(CH3CO)2O按物质的量1:1发生反应生成G的化学方程式为 ,故答案为:
,故答案为: ;
;
(7)以CH3COCH3、CH3CH2MgBr为原料,制备高分子化合物 。要制备
。要制备 需要先合成CH2=C(CH3)-CH=CH2,根据信息Ⅱ,CH3COCH3经过①CH3CH2MgBr、②H2O/H+得到
需要先合成CH2=C(CH3)-CH=CH2,根据信息Ⅱ,CH3COCH3经过①CH3CH2MgBr、②H2O/H+得到 ,
, 消去羟基可以得到CH3-C(CH3)=CH-CH3,经过CH3-C(CH3)=CH-CH3与溴加成再消去溴原子即可得到,CH2=C(CH3)-CH=CH2,CH2=C(CH3)-CH=CH2发生聚合反应即可生成目标产物,因此合成路线为CH3COCH3
消去羟基可以得到CH3-C(CH3)=CH-CH3,经过CH3-C(CH3)=CH-CH3与溴加成再消去溴原子即可得到,CH2=C(CH3)-CH=CH2,CH2=C(CH3)-CH=CH2发生聚合反应即可生成目标产物,因此合成路线为CH3COCH3![]()

![]() CH3-C(CH3)=CH-CH3
CH3-C(CH3)=CH-CH3![]() CH3-CBr(CH3)-CHBr-CH3
CH3-CBr(CH3)-CHBr-CH3![]() CH2=C(CH3)-CH=CH2
CH2=C(CH3)-CH=CH2![]()
 ,故答案为:
,故答案为:![]()

![]() CH3-C(CH3)=CH-CH3
CH3-C(CH3)=CH-CH3![]() CH3-CBr(CH3)-CHBr-CH3
CH3-CBr(CH3)-CHBr-CH3![]() CH2=C(CH3)-CH=CH2。
CH2=C(CH3)-CH=CH2。