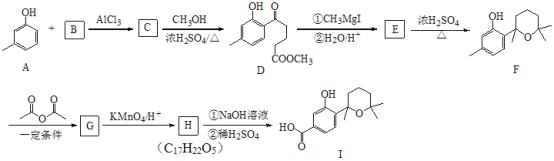
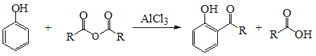
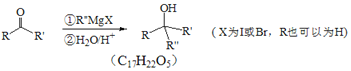
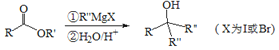
题目内容
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放电时电解质溶液中的OH-向正极移动
【答案】C
【解析】
当该电池放电时为原电池,负极上镉失电子发生氧化反应,正极上NiOOH得电子发生还原反应。放电时负极上发生的电极反应式为:Cd-2e-+2OH-=Cd(OH)2,正极上发生的电极反应式为:NiOOH+e-+H2O═Ni(OH)2+OH-。充电时阳极上发生的电极反应式为:Ni(OH)2+OH--e-=NiOOH+H2O,阴极上发生的电极反应式为:Cd(OH)2+2e-=Cd+2OH-,以此解答该题。
A.放电时,Cd为负极,失去电子,发生氧化反应,电极反应式为:Cd-2e-+2OH-=Cd(OH)2,由于OH-不断消耗,所以溶液的碱性减弱,选项A错误;
B.充电时能量转化是电能转化为化学能,选项B错误;
放电时,电解质溶液中氢氧根离子向负极移动,故B错误;
C.充电时阳极发生氧化反应,电极反应式是:Ni(OH)2-e-+OH-=NiOOH+H2O,选项C正确;
D.放电时电解质溶液中的OH-向负极移动,选项D错误;
故合理选项是C.

【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1、+7 | -3、+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
请完成下列问题:
(1)W在周期表中的位置是___,X与P形成的化合物的电子式___。
(2)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(3)Z与Q两元素的最高价氧化物水化物之间发生反应的离子方程式为___。
(4)Y与R相比,非金属性较强的是___(用元素符号表示),根据下列方法能证明这一结论的是___(填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态
B.R、Y的氢化物稳定性不同
.Y与R形成的化合物中的化合价
D.R、Y的氧化物的水化物的酸性强弱
(5)用电子式表示由Z和R组成的化合物的形成过程___。
(6)如图为X2和R2燃烧反应的能量变化示意图,请根据此图写出该反应的热化学方程式为___(用物质化学式表示)。