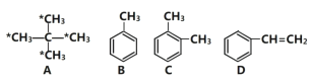
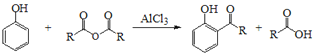
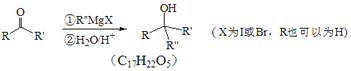
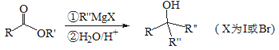
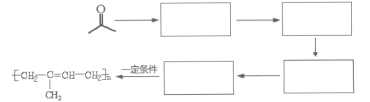
题目内容
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如装置简图:
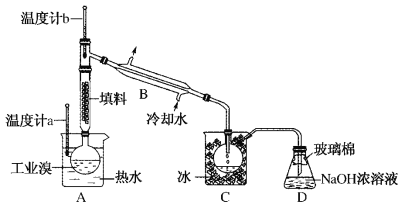
请你参与分析讨论:
(1)图中仪器B的名称:____________________。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________________________________________。
(4)C中液体产物颜色为___________________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是_____________________。
【答案】冷凝管 溴腐蚀橡胶 控制温度计b的温度,并收集59 ℃时的馏分 深红棕色 分液(或蒸馏)
【解析】
本实验题采用蒸馏的方法从工业溴中提纯溴,A装置水浴加热,温度可控受热均匀,经过B装置冷凝可收集到液溴,D装置用于尾气吸收防止空气污染。
(1)图中仪器B的名称是直形状冷凝管;
(2)橡胶塞和橡胶管中有不饱和双键,与溴可以发生加成反应,故溴会腐蚀橡胶;
(3)采用蒸馏法提纯溴关键的条件在于控制温度,温度计a是控制水温(加热的温度),温度计b水银球的位置在蒸馏烧瓶的支管口处,用于测量溴蒸汽的温度,因此关键在于控制温度计b的温度,并收集59 ℃时的馏分;
(4)C中收集到大量的液溴,液溴为红棕色液体;产物中残留少量Cl2,加入NaBr溶液,充分反应(2NaBr+ Cl2=2NaCl +Br2),此时得到大量的液溴和氯化钠的水溶液,上下分层,采用分液进行分离提纯。或由于二者沸点相差很大,采用蒸馏进行分离提纯。
![]()

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理及装置示意图(加热、 夹持及辅助仪器省略)和一些相关信息如下:

名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | ﹣95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
Ⅰ.在b 中加入 2.7 mL 甲苯、100 mL水和几片碎瓷片,开动电动搅拌器,a中通水。将b 中的液体加热至沸腾,分批加入 8.5 g 高锰酸钾,继续搅拌约5 h,停止加热和搅拌,静置。
Ⅱ.在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,再用浓盐酸酸化,苯甲酸全部析出后减压过滤,冷水洗涤,干燥,得到粗产品。
Ⅲ.称取m g产品,配成 100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。请回答下列问题:
(1)装置a的作用___________
(2)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用_______,请用离子方式表示该反应原理_____。
(3)产品减压过滤时用冷水洗涤的原因是_____________
(4)选用下列________(选填字母)操作,可以将粗产品进一步提纯。
A 溶于水后过滤 B 溶于乙醇后蒸馏
C 用甲苯萃取后分液 D 升华
(5)测定纯度步骤中,滴定终点溶液的颜色变化是__。若m=1.200 g,滴定时用去0.1200 mol·L-1 标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为______。