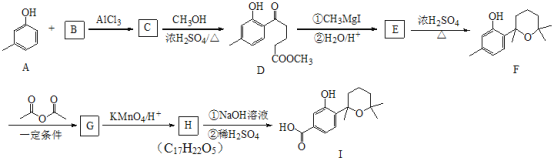
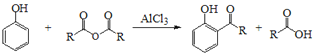
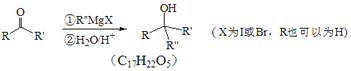
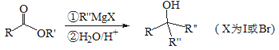
题目内容
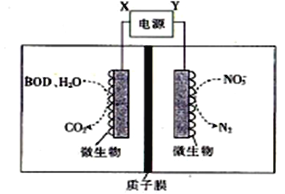
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是
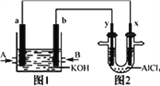
A. 图2中Y电极为阴极
B. 图2中总反应的化学方程式为:2AlCl3+6H2O2![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
C. 图1中电解质溶液的pH增大
D. 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
【答案】B
【解析】根据所给装置的特点分析,图①是燃料电池,图②是电解池。反应开始后观察到x电极附近出现白色沉淀为Al(OH)3,说明X是阴极,氢离子放电,产生OH-,所以得到Al(OH)3沉淀。故a是负极, A处通入通入甲烷气体,发生氧化反应,电极反应式为CH4+10OH--8e-===CO32-+7H2O,由于反应消耗了OH-,电解质溶液的pH减小,A 、C、D均错误;X极:2H++2e-=H2↑,Al3++3OH-= Al(OH)3↓;Y 极2Cl--2e-=Cl2↑;总反应为2AlCl3+6H2O![]() 2Al(OH)3↓+3Cl2↑+3H2↑;B正确;正确选项B。
2Al(OH)3↓+3Cl2↑+3H2↑;B正确;正确选项B。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目