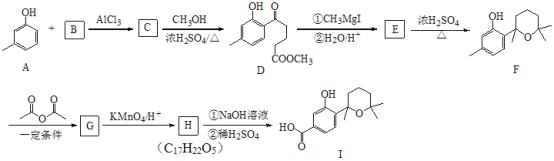
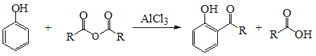
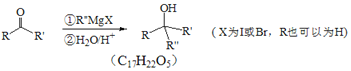
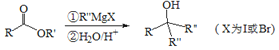
题目内容
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
【答案】C
【解析】
充满 NO2 和 O2 的试管倒立于水槽中,发生反应可能为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的![]() ,试管中剩余
,试管中剩余![]() 体积的气体可能为NO或O2。
体积的气体可能为NO或O2。
设原气体体积为8L,则剩余气体为1L,根据方程式4NO2+O2+2H2O=4HNO3讨论
①若剩余的1L气体为O2,则反应的二氧化氮和氧气共7L,V(NO2)=![]() ×7L=5.6L,V(O2)=8L-5.6L=2.4L,则二氧化氮和氧气的体积比为5.6L:2.4L=7:3,②正确;
×7L=5.6L,V(O2)=8L-5.6L=2.4L,则二氧化氮和氧气的体积比为5.6L:2.4L=7:3,②正确;
②若剩余的1L气体为NO,即相当于剩余3LNO2,则反应的二氧化氮和氧气共5L,V(O2)=![]() ×5L=1L,V(NO2)=8L-1L=7L,则二氧化氮和氧气的体积比为7:1,③正确;故答案为:C。
×5L=1L,V(NO2)=8L-1L=7L,则二氧化氮和氧气的体积比为7:1,③正确;故答案为:C。

【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。

(1)请写出该反应的化学方程式:_____。
(2)若上述反应中X、Y、Z 分别为 NH3、H2、N2,在此 t1 min 时间内,用H2 表示该反应的平均速率 v(H2)为_____。
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应为NH3_____(填:吸收或放出)_____kJ 能量。事实上,将 1molN2 和3molH2 放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是_________。
(4)下列叙述能判断该反应达到平衡状态的是_____(填字母代号)。
A 容器内各气体组分的质量分数不再发生改变
B 正反应速率与逆反应速率相等
C 容器内气体的密度不再发生改变
D 混合气体的平均相对分子质量不再发生改变