题目内容
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式______________。
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是_____。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化 D.混合气体的平均摩尔质量保持不变
(3)合成尿素的反应为 2NH3(g) + CO2(g) =CO(NH2)2(s) + H2O(g)。t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。则t℃时的化学平衡常数为_____,若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将_____(填“增大”、“减小”或“不变”)。
(4)用化学用语和相关文字从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是__________。
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,碳酸根的浓度约为c(CO32-)=____mol/L。(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)。碳酸钙饱和溶液中的离子浓度由大到小排序___________。
【答案】CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1 AC 1 减小 Al3+ +3H2O![]() 3Al(OH)3+3H+、CaCO3(s)
3Al(OH)3+3H+、CaCO3(s)![]() Ca2+(aq)+CO32-(aq),水解产生的H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 4.7×10-5 c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
Ca2+(aq)+CO32-(aq),水解产生的H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 4.7×10-5 c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
【解析】
(1)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJmol-1;②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJmol-1;③H2O(g)═H2O(l);△H=-44.0kJmol-1;根据盖斯定律:①+![]() ×②+2×③得CH3OH(l)+
×②+2×③得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l),由此计算△H;
O2(g)=CO2(g)+2H2O(l),由此计算△H;
(2)根据化学平衡状态特征分析;
(3)t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍,结合三行计算列式计算,气体压强之比等于气体物质的量之比,平衡常数K=![]() ,再向该容器中加入0.5molCO2和1molH2O,计算此时浓度商和平衡常数比较判断反应进行的方向;
,再向该容器中加入0.5molCO2和1molH2O,计算此时浓度商和平衡常数比较判断反应进行的方向;
(4)AlCl3溶液水解显酸性,结合CaCO3的溶解平衡分析可得;
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,由可知CaCO3(s)Ca2+(aq)+CO32-(aq),且CO32-+H2OHCO3-+OH-,水解Kh=![]() ,以此计算c(CO32-),溶液中c(Ca2+)=c(CO32-)+c(HCO3-);在碳酸钙饱和溶液中存在CO32-的分步水解,且一级水解程度大于二级水解,由此确定离子浓度的大小。
,以此计算c(CO32-),溶液中c(Ca2+)=c(CO32-)+c(HCO3-);在碳酸钙饱和溶液中存在CO32-的分步水解,且一级水解程度大于二级水解,由此确定离子浓度的大小。
(1)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJmol-1;②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJmol-1;③H2O(g)═H2O(l);△H=-44.0kJmol-1;根据盖斯定律:①+![]() ×②+2×③得CH3OH(l)+
×②+2×③得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O,则△H=(-359.8kJmol-1)+
O2(g)=CO2(g)+2H2O,则△H=(-359.8kJmol-1)+![]() ×(-556.0kJmol-1)+2×(-44.0kJmol-1)=-725.8 kJmol-1,故甲醇燃烧热的热化学方程式为CH3OH(l)+
×(-556.0kJmol-1)+2×(-44.0kJmol-1)=-725.8 kJmol-1,故甲醇燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O △H=-725.8 kJmol-1;
O2(g)=CO2(g)+2H2O △H=-725.8 kJmol-1;
(2)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)CO2(g)+CO(g)+H2O(g);A.反应气体增多,开始压强增大,平衡时,压强不再变化,故A正确;
B.只有生成物为气体,CO2(g)的体积分数保持占![]() ,故B错误;
,故B错误;
C.根据ρ=![]() ,V不变,气体的质量增大,混合气体的密度不再变化,反应达到平衡,故C正确;
,V不变,气体的质量增大,混合气体的密度不再变化,反应达到平衡,故C正确;
D.只有生成物为气体,根据质量守恒定律,混合气体的平均摩尔质量始终等于草酸的摩尔质量,故D错误;
故答案为AC;
(3)t℃时,若向容积为2L的密闭容器中加入3mol NH3和1molCO2,达到平衡时,结合三行计算列式计算,设反应的二氧化碳为x;
2NH3(g)+CO2(g)CO(NH)2(s)+H2O(g)
起始量(mol) 3 1 0
变化量(mol) 2x x x
平衡量(mol)3-2x 1-x x
气体压强之比等于气体物质的量之比,容器内压强为开始时的0.75倍,3-2x+1-x+x=(3+1)×0.75,解得:x=0.5mol,则反应的平衡常数K=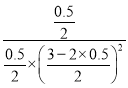 =1;
=1;
再向该容器中加入0.5molCO2和1molH2O,浓度商Qc=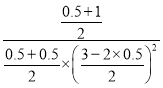 =1.5>K=1,平衡逆向进行,NH3的转化率将减小;
=1.5>K=1,平衡逆向进行,NH3的转化率将减小;
(4)CaCO3在溶液中有溶解平衡:CaCO3(s)Ca2+(aq)+CO32-(aq),Al3+ 水解显酸性,存在的水解反应式为Al3+ +3H2O![]() 3Al(OH)3+3H+,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解,故AlCl3溶液可以溶解CaCO3固体;
3Al(OH)3+3H+,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解,故AlCl3溶液可以溶解CaCO3固体;
(5)常温下,测得某CaCO3的饱和溶液pH=10.0,则c(OH-)=10-4mol/L,溶液中有:CaCO3(s)Ca2+(aq)+CO32-(aq),且CO32-+H2OHCO3-+OH-,则c(HCO3-)=c(OH-)=10-4mol/L,水解Kh=![]() =
=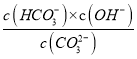 ,即
,即![]() =
= ,则c(CO32-)=4.7×10-5mol/L;在碳酸钙饱和溶液中存在溶解平衡CaCO3(s)Ca2+(aq)+CO32-(aq)和CO32-的分步水解,且一级水解程度大于二级水解,结合溶液显碱性,可知碳酸钙饱和溶液中的离子浓度由大到小排序c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。
,则c(CO32-)=4.7×10-5mol/L;在碳酸钙饱和溶液中存在溶解平衡CaCO3(s)Ca2+(aq)+CO32-(aq)和CO32-的分步水解,且一级水解程度大于二级水解,结合溶液显碱性,可知碳酸钙饱和溶液中的离子浓度由大到小排序c(Ca2+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案