题目内容
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 在该温度下,0.05mol/L的Ba(OH)2溶液的pH=________;
(2)在NaHS溶液中物料守恒:_________
(3)将AgCl分别放入:①5 mL水②40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和③10mL0.1 mol·L-1 MgCl2溶液④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_________(用字母表示)。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最适宜采用的是________(填选项字母)
A.KMnO4 B.H2O2 C.氯水 D.HNO3
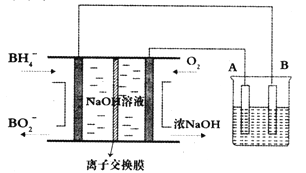
(5)如图所示,是原电池的装置图。请回答:
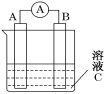
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;反应进行一段时间后溶液C的pH将________(填“变大”、“变小”或“基本不变”)。
【答案】11 c(Na+)=c(H2S)+c(HS-)+c(S2-) a>c>b>d B 2H++2e-=H2↑ 变大
【解析】
(1)依据由水电离的氢离子与氢氧根离子浓度相等先计算出该温度下水的离子积常数,再根据水溶液中KW=c(H+)×c(OH)求得结果;
(2)物料守恒是指溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和。也就是元素守恒(原子守恒),变化前后某种元素的原子个数守恒不变,据此分析;
(3)AgCl在溶液中存在溶解平衡AgCl(s) ![]() Cl-(aq)+Ag+(aq),依据氯离子浓度对沉淀溶解平衡的影响效果作答;
Cl-(aq)+Ag+(aq),依据氯离子浓度对沉淀溶解平衡的影响效果作答;
(4)根据除杂原则作答;
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则此时溶液中的c(OH-)=1×10-6 mol·L-1,所以水的离子积常数 KW=c(H+)×c(OH)=1×10-12,该温度下,0.05mol/L的Ba(OH)2溶液中c (OH-)=0.05mol/L×2=0.1mol/L,则c(H+)=![]() =
=![]() ,则pH=-lgc(H+)=11,
,则pH=-lgc(H+)=11,
故答案为:11;
(2)NaHS溶液中物料守恒式为:c(Na+)=c(H2S)+c(HS-)+c(S2-),
故答案为:c(Na+)=c(H2S)+c(HS-)+c(S2-);
(3)②③④中氯离子的浓度分别是0.3mol/L、0.2 mol/L、0.5 mol/L,四种水溶液中存在沉淀溶解平衡为:AgCl(s) ![]() Cl-(aq)+Ag+(aq),氯离子浓度越大,Ag+的浓度就越小,各溶液中Ag+的浓度从大到小顺序是a>c>b>d,
Cl-(aq)+Ag+(aq),氯离子浓度越大,Ag+的浓度就越小,各溶液中Ag+的浓度从大到小顺序是a>c>b>d,
故答案为:a>c>b>d;
(4)除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,但不能引入新杂质,
A. 引入K+和Mn2+,A项错误;
B. 过氧化氢是绿色氧化剂,本身不稳定,受热易分解,B项正确。
C. 引入Cl-,C项错误;
D. 引入NO3-,D项错误;
故答案为:B;
(5)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;溶液中氢离子放电,导致溶液中氢离子浓度减小,pH值变大,
故答案为:2H++2e-=H2↑;变大。