题目内容
【题目】以下为铝土矿(主要含Fe3O4、Al2O3、SiO2)提取铝的流程,以下说法正确的是( )
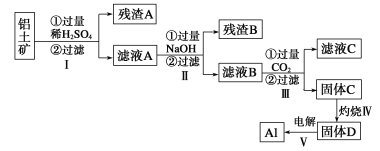
A.残渣A主要是H2SiO3B.滤液A中只存在Fe3+和Al3+
C.过程Ⅲ可以用HCl替代二氧化碳。D.滤液C主要是碳酸氢钠和硫酸钠溶液
【答案】D
【解析】
铝土矿(主要成分为Al2O3、Fe3O4、SiO2)加入过量稀硫酸过滤得到硫酸铝、硫酸铁、硫酸亚铁溶液,二氧化硅不溶形成残渣;滤液中加入过量的氢氧化钠,硫酸铝反应生成偏铝酸钠溶液,硫酸铁、硫酸亚铁反应生成氢氧化铁、氢氧化亚铁沉淀;偏铝酸钠溶液通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液,固体C为氢氧化铝,灼烧分解生成氧化铝,电解熔融的氧化铝得到铝,据此分析解答。
A.根据上述分析,残渣A主要是SiO2,故A错误;
B.根据上述分析,滤液A中存在Fe3+、Fe2+、Al3+,还有过量的稀硫酸,故B错误;
C.过程Ⅲ中如果用HCl替代二氧化碳,过量的盐酸能够将生成的氢氧化铝溶解,因此氯化氢的量不容易控制,故C错误;
D.根据上述分析,滤液C主要是碳酸氢钠和硫酸钠溶液,故D正确;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目