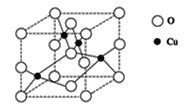
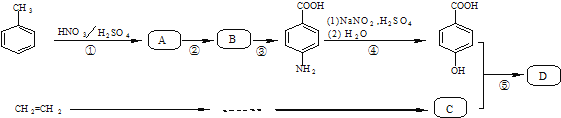
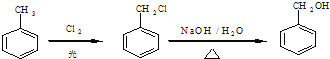
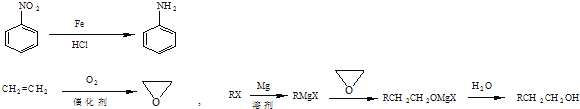题目内容
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:![]()
![]()
![]()
![]() 尾气处理
尾气处理
(1)写出实验室制取Cl2的离子方程式______________________,NA表示阿伏加德罗常数,若有4mol的HCl参加反应,则转移的电子总数为___________;
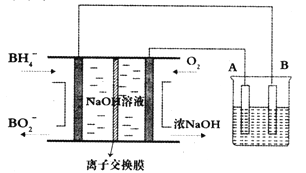
(2)现有以下3种试剂:A.饱和食盐水 B.浓硫酸 C.NaOH溶液
请在以上试剂中选择并回答填空:
X溶液应选用_________(填写序号);Y试剂的作用____________________.
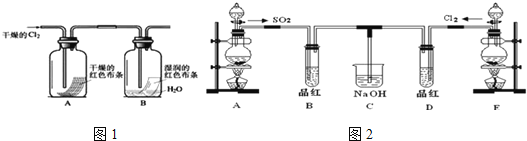
(3)某化学兴趣小组为了探究Cl2的相关性质,设计了如图1的实验.
通入Cl2后,从观察集气瓶A、B中的现象可得出的结论是_____________(写出化学反应方程式,并用简要文字解释).
(4)某兴趣小组的同学为探究和比较SO2和氯水的漂白性,设计了如图2的实验装置.
①实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:______________________;
②反应开始一段时间后,观察到B、D两试管中的品红溶液都出现褪色的现象,但两者褪色原理不同,如何区别,请你帮助设计实验,你的操作是_________________.
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2NA A 除去氯气中混有的水蒸气(或干燥氯气) Cl2+H2O=HClO+HCl,次氯酸有漂性 ①分液漏斗的玻璃塞没有取下来 ②停止通气后,再给B、D两个试管分别加热
MnCl2+Cl2↑+2H2O 2NA A 除去氯气中混有的水蒸气(或干燥氯气) Cl2+H2O=HClO+HCl,次氯酸有漂性 ①分液漏斗的玻璃塞没有取下来 ②停止通气后,再给B、D两个试管分别加热
【解析】
(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;依据方程式可知每生成1mol氯气,有4mol氯化氢参加反应,其中只有2mol氯化氢中﹣1价氯升高为氯气中0价,失去2mol电子,所以有4mol的HCl参加反应,则转移的电子总数为2NA;
MnCl2+Cl2↑+2H2O;依据方程式可知每生成1mol氯气,有4mol氯化氢参加反应,其中只有2mol氯化氢中﹣1价氯升高为氯气中0价,失去2mol电子,所以有4mol的HCl参加反应,则转移的电子总数为2NA;
(2)浓盐酸具有易挥发性,制备的氯气中含有氯化氢和水蒸气,依据氯化氢极易溶于水、氯气在饱和食盐水中溶解度不大,所以X试液为饱和食盐水,作用除去氯气中的氯化氢,浓硫酸具有吸水性选择合适的除杂剂,所以Y为浓硫酸,作用干燥氯气;
(3)通入Cl2后,A中干燥布条不褪色,B中湿润布条褪色,可证明氯气不具有漂白性,氯气与水反应生成氯化氢和次氯酸,次氯酸具有漂白性,方程式:Cl2+H2O=HClO+HCl;
(4)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开;
②二氧化硫漂白性具有不稳定性,受热易恢复颜色,次氯酸漂白具有稳定性,受热不恢复颜色,所以为区别二者可以进行如下操作:停止通气后,再给B、D两个试管分别加热。

 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案