题目内容
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验序 号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为______,b为______。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为_______。
③硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O+4S2O32-+H2O2[Ag(S2O3)2]3-+2OH-。在实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因:_________。
(2)工业上常用空气催化氧化法除去电石渣浆(含 CaO)上清液中的S2-,并制取石膏(CaSO42H2O),其中的物质转化过程如图所示。

①过程Ⅰ、Ⅱ中,起催化剂作用的物质是_________。
②过程Ⅱ中,反应的离子方程式为________。
③根据物质转化过程,若将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为_______L。
【答案】20 2.5 实验Ⅲ溶液中生成黄色沉淀的时间最短 pH高于9.5,OH-浓度过高,反应Ag2O+4S2O32-+H2O2[Ag(S2O3)2]3-+2OH-被抑制,Ag浸出率低;pH低于8.5,S2O32-与H+发生反应,浓度降低,浸出反应平衡左移,浸出率低 Mn(OH)2 2S2-+9H2O +4MnO32-=S2O32-+4Mn(OH)2+10OH- 4.48
【解析】
(1)①根据探究外界条件对化学反应速率的影响的实验要求,I与II的浓度不同,需要控制温度相同;据此判断II与III的温度不同,需要控制浓度相同,据此分析判断;
②升高温度,反应速率加快;
③提高银的浸出率需要调节 pH 的范围为8.5~9.5,结合Ag2O+4S2O32-+H2O2[Ag( S2O3)2]3-+2OH-和Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O分析解答;
(2)①催化剂是在反应中参加反应,然后又生成的物质;②过程Ⅱ中S2-与MnO32-发生氧化还原反应;③根据反应的方程式结合电子守恒及原子守恒分析计算。
(1)①根据探究外界条件对化学反应速率的影响的实验要求,I与II的浓度不同,需要控制温度相同;据此判断II与III的温度不同,需要控制浓度相同,可知a=20,b=13-9-1.5=2.5,故答案为:20;2.5;
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为实验Ⅲ溶液中生成黄色沉淀的时间最短,故答案为:实验Ⅲ溶液中生成黄色沉淀的时间最短;
③实际生产中,为了提高银的浸出率需要调节 pH 的范围为8.5~9.5,因为pH 高于 9.5,OH-浓度过高,反应 Ag2O+4S2O32-+H2O2[Ag( S2O3)2]3-+2OH-被抑制,Ag 浸出率低,而pH 低于 8.5,S2O32-与H+发生反应,浓度降低,浸出反应平衡左移,浸出率低,故答案为:pH 高于 9.5,OH-浓度过高,反应 Ag2O+4S2O32-+H2O2[Ag( S2O3)2]3-+2OH-被抑制,Ag 浸出率低,而pH 低于 8.5,S2O32-与H+发生反应,浓度降低,浸出反应平衡左移,浸出率低;
(2)①催化剂是在反应中参加反应,然后又生成的物质,由图可知,过程Ⅰ、Ⅱ中,起催化剂作用的物质是Mn(OH)2,故答案为:Mn(OH)2;
②根据图示,过程Ⅱ中S2-与MnO32-发生氧化还原反应,离子反应为2S2-+9H2O+4MnO32-═S2O32-+4Mn(OH)2+10OH-,故答案为:2S2-+9H2O+4MnO32-═S2O32-+4Mn(OH)2+10OH-;
③过程I中Mn(OH)2与氧气转化为MnO32-;过程Ⅱ.2S2-+9H2O+4MnO32-═S2O32-+4Mn(OH)2+10OH-;然后S2O32-与氧气反应生成SO42-,由电子守恒及原子守恒可知,存在4Mn(OH)2~4MnO32-~8e-~2O2,4MnO32-~2S2-~S2O32-;S2O32-~2SO42-~8e-~2O2,共两个过程消耗氧气,且消耗的氧气相等,因此S2-~2O2,所以将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为![]() ×2×22.4L/mol=4.48L,故答案为:4.48。
×2×22.4L/mol=4.48L,故答案为:4.48。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。
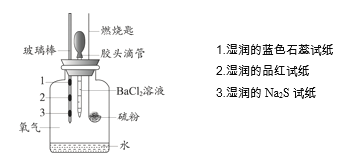
下列实验事实与所得结论相符的是
实验事实 | 所得结论 | |
A | 湿润的品红试纸褪色 | 证明硫燃烧的产物中有SO2 |
B | 湿润的Na2S试纸上出现淡黄色固体 | 证明硫的燃烧产物能被还原成硫 |
C | 湿润的蓝色石蕊试纸变红 | 证明硫的燃烧产物中有酸类物质 |
D | 加入BaCl2溶液产生白色沉淀 | 证明硫燃烧的产物中有SO3 |
A.AB.BC.CD.D