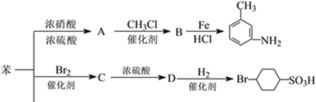
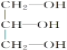题目内容
【题目】氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、金属铋生产中,副产品 NaBiO3可作测定锰的氧化剂。工业上常用辉铋矿(主要成分是Bi2S3,还含有少量SiO2等杂质),制备BiOCl和NaBiO3(二者都难溶于水),其流程如下:
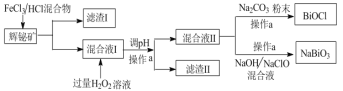
(1)操作a使用的玻璃仪器是_____________,工业上制备HCl的反应原理是:_____。
(2)滤渣I中的成分为________,分离滤渣I中的成分的物理方法是:__________。
(3)请从平衡角度解释调pH产生滤渣Ⅱ的原因:__。
(4)混合液 II 中加入 Na2CO3粉末,当混合液Ⅱ中____________(填实验现象)时,说明BiOCl的生成已完成。混合液II中加入NaOH和NaClO发生的离子方程式________。
(5)加入 H2O2发生反应的离子方程式_______,过滤后,如何洗涤BiOCl固体_______。
【答案】玻璃棒、烧杯、漏斗 H2+Cl2![]() 2HCl SiO2、S 升华 溶液中存在平衡:Fe3++3H2O
2HCl SiO2、S 升华 溶液中存在平衡:Fe3++3H2O ![]() Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀 不再产生气泡; Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O 2Fe2++H2O2+2H+===2Fe3+2H2O 向漏斗中注入蒸馏水至恰好浸没固体,待水自然流出后,重复 2~3 次
Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀 不再产生气泡; Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O 2Fe2++H2O2+2H+===2Fe3+2H2O 向漏斗中注入蒸馏水至恰好浸没固体,待水自然流出后,重复 2~3 次
【解析】
向辉铋矿中加入氯化铁溶液和盐酸,氯化铁与Bi2S3发生氧化还原反应生成氯化铋、氯化亚铁和硫单质,SiO2不反应,过滤,得到滤渣为SiO2和S,滤液中含有Bi3+、H+、Fe2+;向滤液中加入双氧水,双氧水将亚铁离子氧化为三价铁离子,加入加入适量 Bi2O3调节溶液pH,将三价铁离子转化为氢氧化铁沉淀除去,过滤,得到含有Bi3+的滤液;向含有Bi3+的滤液中加入碳酸钠粉末促进Bi3+水解,使Bi3+转化为BiOCl沉淀;向含有Bi3+的滤液中加入氢氧化钠和次氯酸钠混合液,次氯酸钠与Bi3+在碱性条件下发生氧化还原反应生成NaBiO3沉淀。
(1)操作a为过滤,过滤用到的玻璃仪器有玻璃棒、烧杯、漏斗;工业上用氢气在氯气中燃烧制备HCl,反应的化学方程式为H2+Cl2![]() 2HCl,故答案为:玻璃棒、烧杯、漏斗;H2+Cl2
2HCl,故答案为:玻璃棒、烧杯、漏斗;H2+Cl2![]() 2HCl;
2HCl;
(2)向辉铋矿中加入氯化铁溶液和盐酸,氯化铁与Bi2S3发生氧化还原反应生成氯化铋、氯化亚铁和硫单质,SiO2不反应,过滤,得到滤渣I为SiO2和S,二氧化硅是原子晶体,溶沸点高,而硫是分子晶体,受热易升华,则可以用加热升华的方法分离二氧化硅和硫,故答案为:SiO2、S;升华;
(3)氯化铁在溶液中水解,存在溶液中存在平衡:Fe3++3H2O ![]() Fe(OH)3+3H+,加入适量Bi2O3,Bi2O3与 H+反应,使溶液中c(H+)减小,水解平衡向正反应方向移动,产生Fe(OH)3沉淀,从而达到除去铁元素的目的,故答案为:溶液中存在平衡:Fe3++3H2O
Fe(OH)3+3H+,加入适量Bi2O3,Bi2O3与 H+反应,使溶液中c(H+)减小,水解平衡向正反应方向移动,产生Fe(OH)3沉淀,从而达到除去铁元素的目的,故答案为:溶液中存在平衡:Fe3++3H2O ![]() Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀;
Fe(OH)3+3H+,加入适量 Bi2O3(或其它合适物质)与 H+反应,使c(H+)减小,上述平衡正移,产生Fe(OH)3沉淀;
(4)氯化铋在溶液中水解使溶液呈酸性,加入碳酸钠粉末,碳酸钠与氢离子反应生成氯化钠、二氧化碳和水,促进Bi3+水解,使Bi3+转化为BiOCl沉淀,当不再产生气泡是,说明BiOCl的生成已完成;向混合液II中加入NaOH和NaClO混合溶液,次氯酸钠与Bi3+在碱性条件下发生氧化还原反应生成NaBiO3沉淀,反应的离子方程式为Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O,故答案为:不再产生气泡;Na++ Bi3++ClO—=BiOCl↓+Cl—+2H2O;
(5)加入双氧水的目的是在酸性条件下将亚铁离子氧化为三价铁离子,便于调节溶液pH,将三价铁离子转化为氢氧化铁沉淀除去,反应的离子方程式为2Fe2++H2O2+2H+===2Fe3+2H2O;洗涤沉淀的方法是向过滤器中注入蒸馏水至恰好浸没固体,待水自然流出后,重复操作2~3 次即可,故答案为:2Fe2++H2O2+2H+===2Fe3+2H2O;向漏斗中注入蒸馏水至恰好浸没固体,待水自然流出后,重复 2~3 次。

【题目】阿司匹林(乙酰水杨酸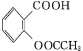 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
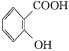 +(CH3CO)2O
+(CH3CO)2O![]()
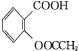 +CH3COOH
+CH3COOH
制备基本操作流程如下:
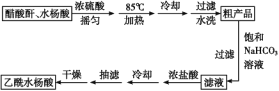
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
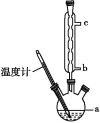
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验序 号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为______,b为______。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为_______。
③硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O+4S2O32-+H2O2[Ag(S2O3)2]3-+2OH-。在实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因:_________。
(2)工业上常用空气催化氧化法除去电石渣浆(含 CaO)上清液中的S2-,并制取石膏(CaSO42H2O),其中的物质转化过程如图所示。

①过程Ⅰ、Ⅱ中,起催化剂作用的物质是_________。
②过程Ⅱ中,反应的离子方程式为________。
③根据物质转化过程,若将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为_______L。