题目内容
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3
Na2SiO3
B. Fe2O3 ![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
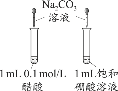
C. 饱和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
D. AgNO3(aq) ![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) ![]() Ag
Ag
【答案】C
【解析】
A.SiO2难溶于水,与水不发生反应,A项错误;
B.氯化铁溶液中存在水解平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,加热,水解平衡右移,氯化氢的挥发使平衡进一步右移,所以直接蒸发氯化铁溶液得到氢氧化铁固体,B项错误;
Fe(OH)3+3HCl,加热,水解平衡右移,氯化氢的挥发使平衡进一步右移,所以直接蒸发氯化铁溶液得到氢氧化铁固体,B项错误;
C.该选项涉及的是侯氏制碱法的基本反应:①NH3+CO2+H2O=NH4HCO3,②NH4HCO3+NaCl=NH4Cl+NaHCO3↓,③2NaHCO3![]() Na2CO3+H2O+CO2↑,C项正确;
Na2CO3+H2O+CO2↑,C项正确;
D.蔗糖是非还原性糖,不能与银氨溶液发生反应生成银,D项错误;
答案选C。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验序 号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为______,b为______。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为_______。
③硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O+4S2O32-+H2O2[Ag(S2O3)2]3-+2OH-。在实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因:_________。
(2)工业上常用空气催化氧化法除去电石渣浆(含 CaO)上清液中的S2-,并制取石膏(CaSO42H2O),其中的物质转化过程如图所示。

①过程Ⅰ、Ⅱ中,起催化剂作用的物质是_________。
②过程Ⅱ中,反应的离子方程式为________。
③根据物质转化过程,若将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为_______L。
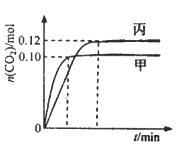
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
容器 | 温度/℃ | 起始物质的量浓度/mol·L-1 | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T1 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率大于40%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)>v(逆)
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
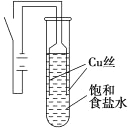
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A. 反应结束后最终溶液呈碱性
B. 阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C. 电解过程中氯离子移向阳极
D. 试管底部红色的固体具有还原性