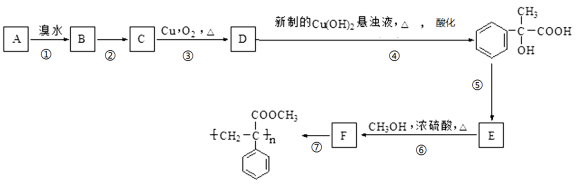
题目内容
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为______________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
。 请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式___________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为__________________。
【答案】31、(1)C8H8
(2)![]() +Br2 →
+Br2 →![]() (3)
(3)![]()
(4)![]() (5)
(5)![]()
【解析】试题分析:(1)1molA中n(C)=104×92.3÷12==8mol,n(H)=104×(192.3%)/1==8,则分子式为C8H8。
(2)该物质含有苯环,能与溴发生反应,说明A为苯乙烯,结构简式为![]() ,与溴发生加成反应生成
,与溴发生加成反应生成![]() ,反应的化学方程式为)
,反应的化学方程式为)![]() +Br2 →
+Br2 →![]() ;
;
(3)A中含有C=C,由![]()
![]()
![]() ,可知生成
,可知生成![]() ;
;
(4)一定条件下,A与氢气反应,可得乙苯或乙基环己烷,得到的化合物中碳的质量分数为85.7%,应为![]() ,其中ω(C)=12×8/12×8+16×100%=85.7%,答案为:
,其中ω(C)=12×8/12×8+16×100%=85.7%,答案为:![]() ;
;
(5)A含有C=C,可发生加聚反应生成聚苯乙烯,即![]() .
.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目