题目内容
【题目】科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如左图):
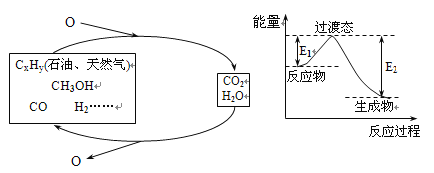
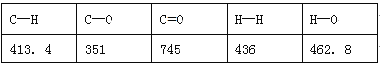
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。右图是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ)分别是:
已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
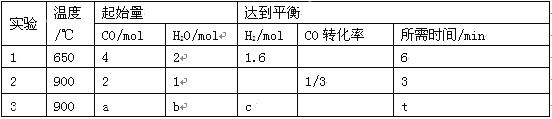
① 该反应的△H___________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为1/3,则a/b=______,c=____。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” ,“>” ,“=”)
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/L Na2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是____________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理______________________________________。
【答案】(1)198.8
(2)①<;②1;③0.5,c=b/3;④=
(3)①c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);②向反应后的溶液中加入少量酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的pH变化不大;加入少量碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的pH变化也不大
【解析】
试题分析:(1)反应热等于反应物中键能之和与生成物中键能之和的差值,则根据方程式CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJ/mol=-181.6kJ/mol。根据图像可知△H=E1-E2=-181.6kJ/mol,所以E2=189.8kJ/mol。
CH3OH(g)+H2O(g)可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJ/mol=-181.6kJ/mol。根据图像可知△H=E1-E2=-181.6kJ/mol,所以E2=189.8kJ/mol。
(2)①650℃根据方程式可知
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 4 2 0 0
转化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则该反应的平衡常数为K=![]()
900℃根据方程式可知
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 2 1 0 0
转化量(mol) 2/3 2/3 2/3 2/3
平衡量(mol) 4/3 1/3 2/3 2/3
此时平衡常数K=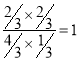
这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,即正反应是放热反应,则该反应的△H<0。
②根据以上分析可知实验2条件下的平衡常数K=1。
③实验3中,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) a b 0 0
转化量(mol) c c c c
平衡量(mol) a-c b-c c c
若平衡时H2O的转化率为1/3,则b=3c
又因为![]()
解得b=2a,即a/b=0.5,c=b/3。
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时浓度熵Q=1=K,因此反应恰好是平衡状态,则V正=V逆。
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/L Na2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①碳酸钠是0.01mol,二氧化碳是0.112L÷22.4L/mol=0.005mol,根据方程式Na2CO/span>3+CO2+H2O=2NaHCO3可知二者反应生成0.01mol碳酸氢钠,另外还剩余0.005mol碳酸钠,则反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
②如果向反应后的溶液中加入少量酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的pH变化不大;如果加入少量碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的pH变化也不大,因此反应后的溶液可以作“缓冲液”。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案