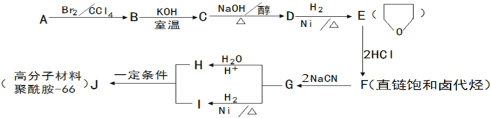
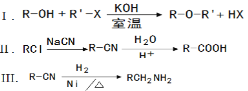
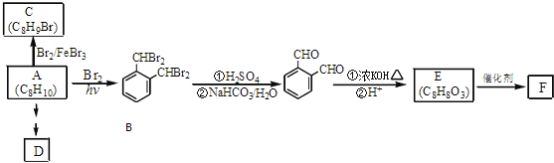
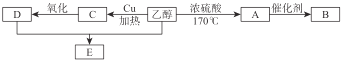
题目内容
【题目】将4 mol A 气体和2 mol B 气体在2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)![]() 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
A. 当A、B、C物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075 mol·L-1·s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
【答案】B
【解析】A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,A错误;B、C的浓度为0.6molL-1,则C的反应速率是0.15molL-1s-1,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 molL-1s-1,B正确;C、达平衡后若通入一定量氦气,压强增大,但浓度不变,平衡不移动,A的转化率不变,C错误;D、该反应正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,D错误,答案选B。

【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。