题目内容
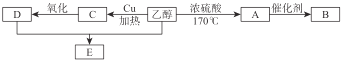
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:
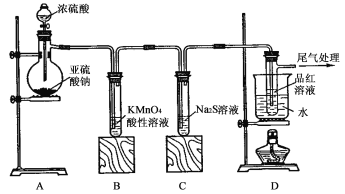
(1)装置A中盛放浓硫酸的仪器名称是____________________;
(2)实验过程中,装置B中发生的现象是 ,说明 SO2 具有 性;装置C中发生的现象是 ,说明 SO2 具有 性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: ;
(4)尾气可采用 溶液吸收,反应方程式为 。
【答案】(1)分液漏斗 (2)紫色褪去 还原性 产生浅黄色浑浊 氧化性
(3)加热烧杯中的水,褪色后的品红恢复红色 (4)NaOH SO2+2NaOH=Na2SO3+H2O
【解析】
试题分析:(1)装置A中盛放浓硫酸的仪器是分液漏斗;
(2)二氧化硫和高锰酸钾溶液发生氧化还原反应生成硫酸,高锰酸钾被还原生成锰离子,二氧化硫能和硫化氢发生反应生成淡黄色沉淀,所以C中出现黄色浑浊,该反应中,二氧化硫中的硫元素化合价由+4价变为0价,所以二氧化硫得电子而作氧化剂,体现氧化性;
(3)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热无色溶液时,溶液又变为红色,其操作方法和现象为:品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色;
(4)二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以能用碱液氢氧化钠溶液吸收,化学反应方程式为SO2+2NaOH=Na2SO3+H2O。

【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
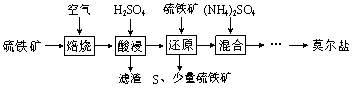
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.50 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。