题目内容
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
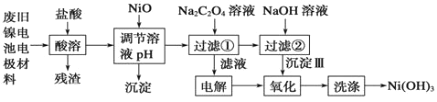
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。![]() H2O > NiC2O4
H2O > NiC2O4![]() 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一 ![]() Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一![]() Ni2O3+3 H2O
Ni2O3+3 H2O
【答案】(1)碳粉
(2)Fe(OH)3;Al(OH)3;
(3)Na2C2O4+NiCl2+2H2O=2NaCl+NiC2O4·2H2O↓
(4)NiC2O4+2OH-=Ni(OH)2↓+C2O42-(2分)8.0×105L.mol-1
(5)2H2O+2e-═H2↑+2OH-;(2分)2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-
(6)B
【解析】
试题分析:(1)碳粉不溶于水、酸,酸溶后所留残渣的主要成份为碳粉。
故答案为:碳粉;
(2)用NiO调节溶液的pH,先生成Fe(OH)3沉淀,然后生成Al(OH)3沉淀。
故答案为:Fe(OH)3;Al(OH)3;
(3)NiCl2可与Na2C2O4反应生成NiC2O4![]() 2H2O和NaCl,反应的化学方程式为NiCl2+Na2C2O4+2H2O═NiC2O4
2H2O和NaCl,反应的化学方程式为NiCl2+Na2C2O4+2H2O═NiC2O4![]() 2H2O↓+2NaCl。
2H2O↓+2NaCl。
故答案为:Na2C2O4+NiCl2+2H2O=2NaCl+NiC2O4![]() 2H2O↓;
2H2O↓;
(4)加入NaOH溶液,NiC2O4沉淀转化为Ni(OH)2,NiC2O4+2OH-Ni(OH)2+C2O42-,根据Ksp(NiC2O4):4.0×10-10,c(Ni2+)=c(C2O42-)= ![]() =2×10-5mol/L;
=2×10-5mol/L;
根据Ksp[Ni(OH)2]:5.0×10-16,c2(OH-)= ![]() =
= ![]() =2.5×10-11mol2/L2;
=2.5×10-11mol2/L2;
则该反应的平衡常数![]() =
= ![]() =8×105L/mol。
=8×105L/mol。
故答案为:NiC2O4+2OH-= Ni(OH)2↓+C2O42-;8.0×105L.mol-1;
(5)电解过程中阴极反应是水得电子产生氢气,电解NaCl溶液可以得到氧化性物质氯气,所以沉淀Ⅲ可被电解所得产物Cl2氧化生成Ni(OH)3,电极反应式为:2H2O+2e-═H2↑+2OH-;Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-。
故答案为:2H2O+2e-═H2↑+2OH-;2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-;
(6)A.根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,故A正确;B.充电时消耗氢氧根,阴极附近溶液的pH升高,故B错误;C.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,故C正确;D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故D正确
故答案为:B。