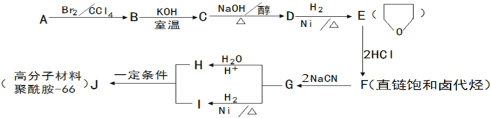
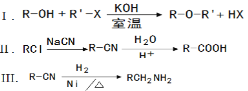
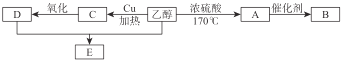
题目内容
【题目】为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,某学生取mg硫酸亚铁铵样品配置成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验。
![]()
(1)方案一的离子方程式为 ;
判断达到滴定终点的依据是 ;
(2)方案二的离子方程式为 ;若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为 ,如何验证你的假设 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00mL硫酸亚铁铵溶液进行该实验。
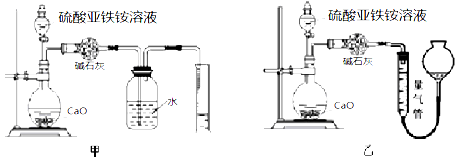
(3)①装置 (填“甲”或“乙”)较为合理,判断理由是
。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
A.水 B.饱和NaHCO3溶液 C.CCl4
②选用该装置会导致测量值总是偏大一些,分析原因 。
③若测得NH3的体积为VL(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
(列出计算式即可,不用简化)。
【答案】(1)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分) 当滴加最后一滴酸性高锰酸钾溶液时,溶液刚好变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点(2分)
(2)SO42-+Ba2+=BaSO4↓(1分);Fe2+ 已被空气部分氧化(1 分)取少量硫酸亚铁铵溶液,加入少量 KSCN 溶液,若溶液变为血红色,说明 Fe2+ 已被空气部分氧化; (2 分)
(3)①乙(1 分) 氨气极易溶于水,甲装置无法排液体,甚至会出现倒吸(2 分)c(1 分)
②装置内的空气被量出导致测量值偏大(1 分)
③![]() (2 分)
(2 分)
【解析】
试题分析:
(1)在方案一中KMnO4具有强的氧化性,会把硫酸亚铁铵中的Fe2+氧化产生Fe3+,MnO4-被还原产生Mn2+,根据电子守恒、电荷守恒及原子守恒可得反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;MnO4-的水溶液是紫色的,Mn2+是无色的,在滴定达到终点时,锥形瓶内溶液由浅绿色变为浅紫色,且半分钟内不再恢复原色,就说明达到滴定终点。
(2)方案二中会发生复分解反应:SO42-+Ba2+=BaSO4↓;
若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+具有还原性,容易被空气部分氧化,但是SO42-的物质的量不变,故使其准确度下降;
验证Fe2+被氧化的假设的实验方法是少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(3)①测定NH4+的含量是通过测定NH3的体积的方法,由于氨气及容易溶于水,实验不能通过排水的方法测定其体积,并且甲装置无法排液体,甚至会出现倒吸故乙用排气的方法测定其体积较为合理;
氨气极易溶于水,所以量气管中最佳试剂是氨气不能溶解的液体物质,可以是四氯化碳,故选项c正确;
②装置内的空气被量出导致测量值偏大
③若测得NH3的体积为VL(已折算为标准状况下),n(NH3)=VL÷22.4L/mol=V/22.4mol,根据N元素守恒可知n[(NH4)2SO4·FeSO4·6H2O]=1/2 n(NH3)=V/(2×22.4)mol,所以则该硫酸亚铁铵晶体的纯度为
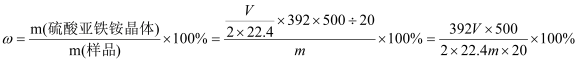

【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
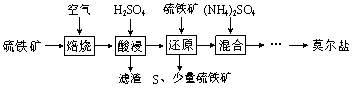
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.20 | 3.50 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。