题目内容
18.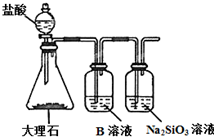 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
分析 由元素在周期表在的位置可知,X为C,Y为N,G为F,Z为Na,H为Al,W为Si,E为Cl,Q为Br.
(1)非金属性越强,得电子能力越强;
(2)E元素与Q元素两者核电荷数分别为17、35;
(3)具有相同排布的离子,原子序数大的离子半径小;
(4)Z的最高价氧化物对应水化物为NaOH,与Al反应生成偏铝酸钠和氢气;
(5)根据强酸制取弱酸的反应原理可知,B中试剂除去二氧化碳中的HCl,结合非金属性越强,最高价氧化物的水化物的酸性越强分析.
解答 解:由元素在周期表在的位置可知,X为C,Y为N,G为F,Z为Na,H为Al,W为Si,E为Cl,Q为Br.
(1)上述元素中F(氟)的非金属性最强,得电子能力最强,故答案为:氟;
(2)E元素与Q元素两者核电荷数分别为17、35,核电荷数之差是35-17=18,故答案为:18;
(3)具有相同排布的离子,原子序数大的离子半径小,则Z的原子序数大,其离子半径小,所以G对应离子的半径>Z对应离子的半径,故答案为:>;
(4)Z的最高价氧化物对应水化物为NaOH,与Al反应生成偏铝酸钠和氢气,反应的离子反应为2Al+2OH-+2H2O═2AlO2-+2H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+2H2↑;
(5)比较元素X和W的非金属性强弱,图中装置中发生强酸制取弱酸的反应原理,B中试剂除去二氧化碳中的HCl,说明X和W非金属性强弱,则装置中最后的试剂瓶中发生二氧化碳与硅酸钠的反应生成硅酸,离子反应为CO2+SiO32-+H2O═CO32-+H2SiO3↓,故答案为:除去CO2中的HCl;CO2+SiO32-+H2O═CO32-+H2SiO3↓.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,(5)中酸性比较注意B为除杂是解答的易错点,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 反应体系的总压恒定 | B. | A、B的浓度相等 | ||
| C. | c(A):c(B)=1:3 | D. | 2v(B)正=3v(C)逆 |
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ/mol |
| A. | 氢的同位素中重氢原子的符号:13H | |
| B. | Mg2+的结构示意图: | |
| C. | 氨气的电子式: | |
| D. | Ca(ClO)2的电离方程式:Ca(ClO)2=Ca2++2ClO- |
| A. | H2在Cl2中燃烧 | B. | 石灰石分解 | ||
| C. | Na和H2O的反应 | D. | Ba(OH)2•8H2O和NH4Cl固体的反应 |
| A. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| B. | 有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 | |
| C. | 人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 | |
| D. | 高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl 加成反应 | |
| B. | 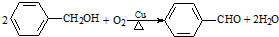 氧化反应 氧化反应 | |
| C. |  加成反应 加成反应 | |
| D. | 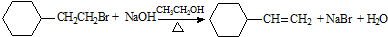 取代反应 取代反应 |
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热△H=-110.5 kJ•mol-1 |
| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |