题目内容
8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |
分析 A.标况下三氧化硫不是气体;
B.过氧化钠与二氧化碳反应,过氧化钠既做氧化剂又做还原剂,消耗1mol过氧化钠转移1mol电子;
C.只有浓硫酸与铜反应,稀硫酸与铜不反应;
D.粗铜中含有杂质铁、锌等较活泼金属,电解过程中铁、锌优先放电.
解答 解:A.气体摩尔体积适用对象为气体,标况下三氧化硫不是气体,不能使用气体摩尔体积,故A错误;
B.78g Na2O2的物质的量为1mol,与过量CO2反应,CO2转移的电子数为NA,故B错误;
C.随着反应进行,浓硫酸浓度降低,变为稀硫酸不再发生反应,所以含0.2mol H2SO4的浓硫酸与足量铜充分反应,消耗的硫酸小于0.2mol,生成的二氧化硫的数目小于0.1NA,故C正确;
D.电解精炼铜时,若阳极质量减少32g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少32g,转移的电子的物质的量大于1mol,则阴极得到的电子数大于NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,注意只有浓硫酸与铜才能发生反应,题目难度不大.

练习册系列答案
相关题目
18.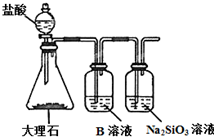 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
(1)上述元素的原子中,得电子能力最强的是氟(填元素名称).
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
19.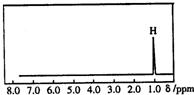 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )| A. | CH3C(CH3)3 | B. | CH3CH2CH3 | C. | CH2=CHCH3 | D. | (CH3)2CHCH3 |
16.常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 向0.1mol•L-1pH=2的HF溶液加水稀释,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O溶液和NH4Cl溶液等体积混合:c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
3.下列对各组离子或物质是否能够大量共存的判断及解释一定正确的是( )
| A | 25℃时,由水电离出来的c(H+)和c(OH-)的乘积为1×10-2 4的某溶液中: Fe2+、NO3-、AlO2-、Na+ | 不能共存 | 发生反应: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B | 澄清石灰水中: Ca2+、K+、CH3COO-、HCO3- | 不能共存 | 发生反应: Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C | 常温常压下,空气中: NH3、NO、H2、CO2 | 可以共存 | 不能发生反应 |
| D | 银氨溶液中: K+、Na+、NO3-、Cl- | 可以共存 | 不能发生反应 |
| A. | A | B. | B | C. | C | D. | D |
13.X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.M是地壳中含量最高的金属元素.下列说法正确的是( )
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |
20.下列属于加成反应的是( )
| A. | 乙醇与乙酸在浓硫酸加热条件下反应 | |
| B. | 乙烯通入溴的四氯化碳溶液 | |
| C. | 苯与浓硝酸、浓硫酸的混合物共热 | |
| D. | 乙醇在铜粉存在下与氧气反应 |
17.苯环上有两个取代基的C9H12,其一氯代物的同分异构体共有( )
| A. | 9种 | B. | 16种 | C. | 19种 | D. | 22种 |
18.下列说法正确的是( )
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |