题目内容
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①T℃时,向容积为2L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2:5,该反应的平衡常数K=___________;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将___________移动。(填“向正反应方向”“不”或“向逆反应方向”)
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是___________。b、d点的正反应速率vb(CO)_______va(CO).
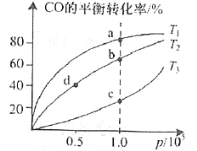
(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
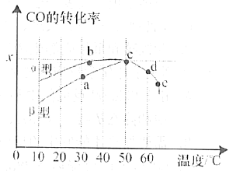
①a、b、c、d四点中表示平衡状态的是___________;
②e点转化率出现突变的原因可能是______________________。
(3)电解法转化CO2可实现CO2资源化利用。电解时CO2在阴极区转化为HCOOH,其原理示意图如下:
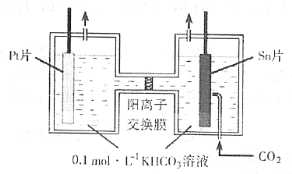
电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_________________________。
【答案】100 正反应方向 K(a) > K(b) > K(c) > c、d 温度升高后催化剂失去活性 阳极产生O2,pH降低,HCO3-的浓度降低,K+部分迁移至阴极区
【解析】
(1)①同一容器中,两种气体的体积之比等于物质的量之比,计算出平衡时反应物生成物各自的物质的量浓度,然后计算平衡常数,达到平衡后再通入0.4 mol CO和0.2 mol CH3OH(g),计算此时的浓度商,然后与平衡常数对比;
②CO(g)+2H2(g)![]() CH3OH(g) △H<0,该反应正反应为放热反应,当压强相同时,温度越高CO的平衡转化率越低,结合图象,T1<T2<T3,对应放热反应,温度越高,平衡常数越小;同温时压强越大反应速率越快;
CH3OH(g) △H<0,该反应正反应为放热反应,当压强相同时,温度越高CO的平衡转化率越低,结合图象,T1<T2<T3,对应放热反应,温度越高,平衡常数越小;同温时压强越大反应速率越快;
(2)①对应放热反应,当反应达到平衡后,升高温度平衡要逆向移动,反应物转化率下降,判断a、b、c、d四点中哪个点处于平衡状态;
②e点转化率出现突变的原因可能是温度升高催化剂中毒,失去活性;
(3)阳极产生发生的电极反应式为:2H2O-4e-=O2↑+4H+,阳极产生的H+与HCO3-反应,导致HCO3-的浓度降低,K+部分迁移至阴极区。
(1)①CO(g)+2H2(g)![]() CH3OH(g),T℃时,向容积为2L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,令反应消耗CO的物质的量为xmol,反应中反应物、生成物物质的量变化之比等于化学计量数之比,故反应消耗H2的物质的量为2xmol,反应生成CH3OH的物质的量为xmol,故平衡时n(CO)=(1-x)mol,n(H2)=(1.2-2x)mol,n(CH3OH)=xmol,同一容器中,两气体的体积之比等于物质的量之比,(1.2-2x):x=2:5,x=5/6,x=0.5,故平衡时n(CO)=0.5mol,n(H2)=0.2mol,n(CH3OH)=0.5mol,c(CO)=0.25 mol·L-1,c(H2)=0.1mol·L-1,c(CH3OH)= 0.25 mol·L-1,K=0.25/[0.25×(0.1)2]=100;此时向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),容器中CO、CH3OH的物质的量浓度变为0.45 mol·L-1、0.35 mol·L-1,Qc=0.35/[0.45×(0.1)2]=77.7<100,说明此时平衡向正反应方向移动;
CH3OH(g),T℃时,向容积为2L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,令反应消耗CO的物质的量为xmol,反应中反应物、生成物物质的量变化之比等于化学计量数之比,故反应消耗H2的物质的量为2xmol,反应生成CH3OH的物质的量为xmol,故平衡时n(CO)=(1-x)mol,n(H2)=(1.2-2x)mol,n(CH3OH)=xmol,同一容器中,两气体的体积之比等于物质的量之比,(1.2-2x):x=2:5,x=5/6,x=0.5,故平衡时n(CO)=0.5mol,n(H2)=0.2mol,n(CH3OH)=0.5mol,c(CO)=0.25 mol·L-1,c(H2)=0.1mol·L-1,c(CH3OH)= 0.25 mol·L-1,K=0.25/[0.25×(0.1)2]=100;此时向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),容器中CO、CH3OH的物质的量浓度变为0.45 mol·L-1、0.35 mol·L-1,Qc=0.35/[0.45×(0.1)2]=77.7<100,说明此时平衡向正反应方向移动;
②CO(g)+2H2(g)![]() CH3OH(g) △H<0,该反应正反应为放热反应,当压强相同时,温度越高CO的平衡转化率越低,结合图象,T1<T2<T3,正反应为放热反应,温度越高,正反应的平衡常数越小,故K(a) > K(b) > K(c);在其他条件相同时,增大压强,化学反应速率加快,由于压强b> d,vb(CO) > va(CO).;
CH3OH(g) △H<0,该反应正反应为放热反应,当压强相同时,温度越高CO的平衡转化率越低,结合图象,T1<T2<T3,正反应为放热反应,温度越高,正反应的平衡常数越小,故K(a) > K(b) > K(c);在其他条件相同时,增大压强,化学反应速率加快,由于压强b> d,vb(CO) > va(CO).;
(2)①当反应达到平衡后,升高温度平衡要逆向移动,CO的转化率降低,则a、b、c、d四点中表示平衡状态的是c、d;
②e点转化率出现突变的原因可能是温度升高后催化剂失去活性;
(3)阳极产生发生的电极反应式为:2H2O-4e-=O2↑+4H+,阳极产生的H+与HCO3-反应,H++ HCO3-= CO2↑+H2O,HCO3-的浓度降低,K+部分迁移至阴极区。

【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
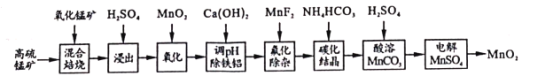
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)写出浸出时与铝元素有关的离子反应方程式____。
(2)上述“氧化”步骤是否可省略____(填“是”或“否”),你的依据是 _____。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为____;“氟化除杂”中除去的离子为____。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程___(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为____;整个流程中能够循环利用的物质除MnO2外还有___(写名称)。