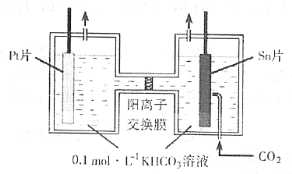
题目内容
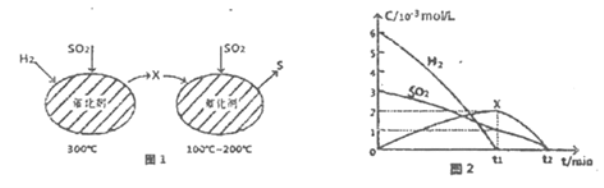
【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
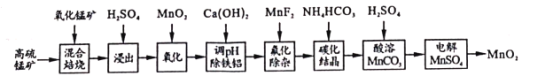
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)写出浸出时与铝元素有关的离子反应方程式____。
(2)上述“氧化”步骤是否可省略____(填“是”或“否”),你的依据是 _____。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为____;“氟化除杂”中除去的离子为____。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程___(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为____;整个流程中能够循环利用的物质除MnO2外还有___(写名称)。
【答案】Al2O3+6H+=3H2O+2Al3+ 否 若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会被部分沉淀,造成损失 5.0≤pH<7.5 Mg2+、Ca2+ 加入NH4HCO3后,Mn2+与HCO3-电离出的CO32-生成MnCO3,HCO3-H++ CO32-、Mn2++CO32-MnCO3,HCO3-电离出H+与另一部分HCO3-反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
【解析】
高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿混合焙烧,得到MnSO4、Fe2O3及少量FeO、Al2O3、MgO,加入硫酸,得到Mn2+、Fe2+、Fe3+、Mg2+、Al3+的酸性溶液,加入二氧化锰将亚铁离子氧化为铁离子便于除去,再加入碳酸钙中和,将铁离子与铝离子以氢氧化物的形式除去,加入MnF2除杂,使溶液中的Mg2+、Ca2+沉淀完全,此时溶液中的金属离子为锰离子,加入碳酸氢铵发生Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,加入硫酸溶解碳酸锰得到硫酸锰溶液,经过电解得到二氧化锰,据此分析解答。
(1)浸出时Al2O3与硫酸反应生成硫酸铝,与铝元素有关的离子反应方程式为:Al2O3+6H+=3H2O+2Al3+;
(2)根据沉淀表格数据,若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会被部分沉淀,造成损失,则上述“氧化”步骤不可省略;
(3)“调pH除铁铝’’时,根据数据,pH为5.0时铝离子完全沉淀,pH为7.5时锰离子开始沉淀,则生成沉淀的pH范围为5.0≤pH<7.5;根据分析,“氟化除杂”中加入MnF2除杂,使溶液中的Mg2+、Ca2+沉淀完全,除去的离子为Mg2+、Ca2+;
(4)加入NH4HCO3后,Mn2+与HCO3-电离出的CO32-生成MnCO3,HCO3-H++ CO32-、Mn2++CO32-MnCO3,HCO3-电离出H+与另一部分HCO3-反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀;
(5)用惰性电极电解MnSO4制备MnO2时,其阳极发生氧化还原,化合价升高失电子,锰元素由+2价升高为+4价,失电子被氧化,则阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+;硫酸根离子与氢离子结合生成硫酸,则整个流程中能够循环利用的物质除MnO2外还有硫酸。

【题目】含碳化合物种类繁多。回答下列问题:
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为_________%。
CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为_________%。
(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正______(填“增大”“减小”或“不变”,下同),v逆_______,平衡常数K________,转化率α________;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正______(填“增大”“减小”或“不变”,下同),v逆_______,平衡常数K________,转化率α________;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO2)/mol/L | c(H2)/mol/L | c(CH4)/mol/L | c(H2O)/mol/L | |
平衡I | a | b | c | d |
平衡II | m | n | x | y |
则a、b、c、d与m、n、x、y之间的关系式为_____________。
(3)已知相关物质的电离平衡常数如下表:

①0.1 mol·L-1的Na2CO3溶液的pH_______(填“大于”“小于”或“等于”)0.1 mol·L-1的Na2C2O4溶液的pH。
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中粒子浓度大小的顺序正确的是_________(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(CO32-)>c(C2O42-) d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]()
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。