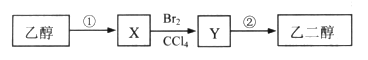
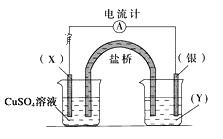
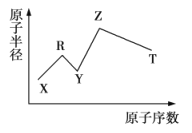
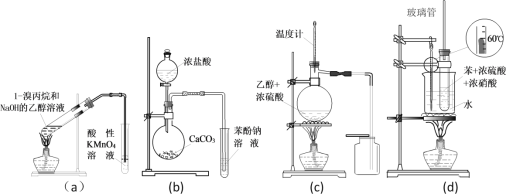
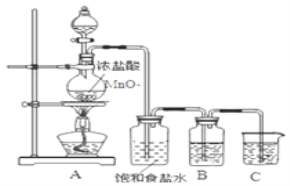
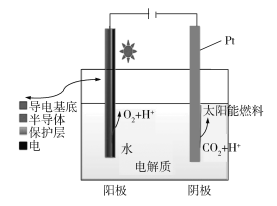
题目内容
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
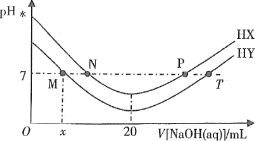
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
【答案】D
【解析】
A. 依题意,HX和HY是两种一元酸。由图象知,加入氢氧化钠溶液,水电离程度增大,溶液由酸性逐渐变为中性,当恰好完全反应时溶液呈碱性且水电离程度达到最大值。HX为弱酸,故A错误。
B. T、P点对应的溶液都呈碱性,故B错误。
C. N点呈中性,加入蒸馏水稀释中性溶液,稀释后溶液仍然呈中性,故C错误。
D. 取M点计算电离常数,c(H+)=c(OH-)=1×10-7mol·L-1,混合溶液中![]() ,
,![]() ,
,![]() ,故D正确。
,故D正确。
故答案选D。

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目