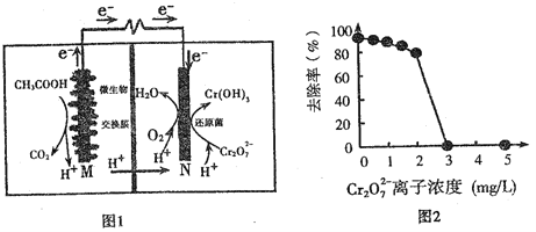
题目内容
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是
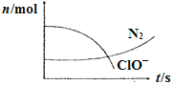
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为2:5
D.标准状况下若生成2.24LN2则转移电子为1mol
【答案】BC
【解析】
由图可知,ClO-是反应物、N2是生成物,结合元素守恒知,CN-为反应物、Cl-生成物,反应中C元素应该生成物HCO3-,根据元素守恒知水是反应物,根据原子守恒、电子守恒、电荷守恒配平方程式为5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-,氧化剂是ClO-、还原剂是CN-,以此来解答。
A、还原剂是CN-,还原剂对应的产物是氧化产物,氧化产物是N2、HCO3-,故A正确;
B、氧化剂的ClO-,还原剂对应的产物是氧化产物,氧化产物是N2、HCO3-,故B错误;
C、氧化剂是ClO-、还原剂是CN-,其计量数之比等于物质的量之比,则氧化剂和还原剂的物质的量之比为5:2,故C错误;
D、标况下生成2.24L氮气时,其物质的量为0.1mol,生成0.1mol氮气同时还生成0.2molHCO3-,转移电子物质的量为0.1mol×2×[0-(-3)]+0.2mol×(4-2)=1mol,故D正确。
答案选BC。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。
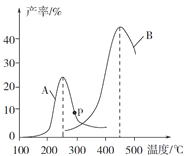
(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]()
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
【题目】如图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷舟内的烃样品经加热分解或气化后用纯![]() 流驱赶经过灼热的
流驱赶经过灼热的![]() ,这里烃类化合物反应变成
,这里烃类化合物反应变成![]() 和
和![]() ,经吸收管吸收。
,经吸收管吸收。
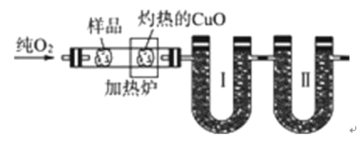
已知下表数据:
瓷舟 | 吸收管Ⅰ | 吸收管Ⅱ | |||
瓷舟 | 样品+瓷舟 | 吸收前 | 吸收后 | 吸收前 | 吸收后 |
A | B | C | D | E | F |
(1)烃样品在反应过程中所用的氧化剂是________________________;
(2)吸收管Ⅰ应装的吸收剂是____________,吸收管Ⅱ应装的吸收剂是____________;
(3)样品中碳的质量分数的数学表达式是________________________;
(4)取该烃![]() 在氧气中充分燃烧后,生成
在氧气中充分燃烧后,生成![]() 和
和![]() 。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。
。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。