题目内容
5.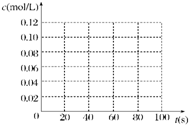 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
从表中分析:c1<c2;c3=c4(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol/(L•s).
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是B
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He.
分析 (1)化学平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;根据二氧化氮和四氧化二氮之间的关系式知,如果生成0.060mol/L的二氧化氮,则需要消耗0.030mol/L的四氧化二氮,所以c1=(0.100-0.030)mol/L=0.070mol/L;如果还剩余0.050mol/L四氧化二氮,则参加反应的四氧化二氮为(0.100-0.050)mol/L=0.050mol/L,则c2=0.100mol/L;
60s、80s时,二氧化氮浓度不变,说明该反应达到平衡状态,反应体系中各物质的物质的量浓度不变;
(2)随着反应的进行,二氧化氮浓度增大、四氧化二氮浓度减小,达到平衡状态时时间为60s,二氧化氮浓度为0.12mol/L,四氧化二氮浓度=(0.100-0.060)mol/L=0.040mol/L;
(3)四氧化二氮的平均反应速率=$\frac{△c}{△t}$;
(4)可以通过增大反应物浓度、减小压强实现.
解答 解:(1)化学平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;根据二氧化氮和四氧化二氮之间的关系式知,如果生成0.060mol/L的二氧化氮,则需要消耗0.030mol/L的四氧化二氮,所以c1=(0.100-0.030)mol/L=0.070mol/L;如果还剩余0.050mol/L四氧化二氮,则参加反应的四氧化二氮为(0.100-0.050)mol/L=0.050mol/L,则c2=0.100mol/L,所以c1<c2;
60s、80s时,二氧化氮浓度不变,说明该反应达到平衡状态,反应体系中各物质的物质的量浓度不变,所以
c3=c4,故答案为:K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;<;=;
(2)随着反应的进行,二氧化氮浓度增大、四氧化二氮浓度减小,达到平衡状态时时间为60s,二氧化氮浓度为0.12mol/L,四氧化二氮浓度=(0.100-0.060)mol/L=0.040mol/L,所以其变化曲线为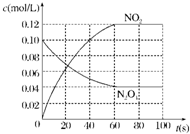 ,故答案为:
,故答案为: ;
;
(3)四氧化二氮的平均反应速率=$\frac{△c}{△t}$=$\frac{\frac{0.12mol/L}{2}×1}{60s}$=0.001mol/(L.s),
故答案为:0.001;
(4)A.增大容器的容积,减小压强,平衡正向移动,但二氧化氮物质的量增大程度小于容器体积增大程度导致二氧化氮浓度减小,故错误;
B.再充入一定量的N2O4,平衡正向移动,二氧化氮浓度增大,故正确;
C.分离出一定量的NO2导致二氧化氮物质的量减小,浓度降低,故错误;
D.再充入一定量的He,平衡不移动,二氧化氮浓度不变,故错误;
故选B.
点评 本题考查化学平衡计算、平衡影响因素等知识点,明确外界条件对化学平衡移动的影响原理是解本题关键,知道平衡状态判断方法,易错点是(4)题AD,题目难度不大.

| A. | 同位素(${\;}_{1}^{1}$H20与${\;}_{1}^{2}$H2O) | B. | 同素异形体(13C与C60) | ||
| C. | 同分异构体( 与CH3COOH) 与CH3COOH) | D. | 同系物(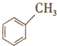 与 与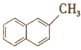 ) ) |
 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )| A. | 能与氢气反应 | B. | 能与金属钠反应 | ||
| C. | 能与NaOH溶液反应 | D. | 不能与新制Cu(OH)2悬浊液反应 |
| A. | 离子组K+、Fe2+、NO3-、I-因发生氧化还原反应而不能大量共存 | |
| B. | 离子组K+、Na+、ClO-、Cl-中加入稀硫酸后还能够大量共存 | |
| C. | 过量SO2通入氨水的反应为SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| D. | Na2CO3溶液显碱性的原因主要是CO32-+H20?HCO3-+OH- |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 氨易液化,因此可用来作制冷剂 | |
| B. | 氨极易溶于水,因此可用来作喷泉实验 | |
| C. | 氨极易溶于水,因此一水合氨比较稳定(不容易分解) | |
| D. | 氨溶于水显弱碱性,因此可使酚酞试剂变为红色 |
 Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物.请回答下列问题:
Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物.请回答下列问题: