题目内容
14.关于氨的下列叙述中,错误的是( )| A. | 氨易液化,因此可用来作制冷剂 | |
| B. | 氨极易溶于水,因此可用来作喷泉实验 | |
| C. | 氨极易溶于水,因此一水合氨比较稳定(不容易分解) | |
| D. | 氨溶于水显弱碱性,因此可使酚酞试剂变为红色 |
分析 A.氨气沸点高,液化,液态氨气汽化吸收大量的热;
B.根据喷泉实验产生的原理:气体极易溶于液体或是气体极易和液体碱反应,导致气压差出现;
C.一水合氨不稳定,受热易分解;
D.根据碱使酚酞试剂变为红色,与碱的强弱无关;
解答 解:A.液氨汽化吸收大量的热,所以能够做制冷剂,故A正确;
B.NH3都极易溶于水导致气压差出现,符合喷泉实验产生的条件,故B正确;
C.一水合氨不稳定,受热易分解,故C错误;
D.因碱使酚酞试剂变为红色,强碱、弱碱都可以,故D正确;
故选:C.
点评 本题考查了氨气的性质,熟悉氨气的物理性质和化学性质是解题关键,注意喷泉实验的原理.

练习册系列答案
相关题目
5.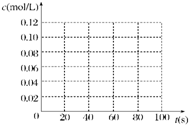 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
(1)该反应的平衡常数表达式为K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
从表中分析:c1<c2;c3=c4(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol/(L•s).
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是B
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He.
 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
从表中分析:c1<c2;c3=c4(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol/(L•s).
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是B
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He.
2.下列说法中正确的是( )
| A. | 化学性质相似的有机物是同系物 | |
| B. | C3H6和C2H4一定是同系物 | |
| C. | CH3CH(CH2CH3)2和3-甲基戊烷一定是同分异构体 | |
| D. | 相对分子质量和元素及其质量分数都相同的不同分子一定是同分异构体 |
19.下列哪种物质不属于以石油、煤和天然气为主要原料生产的三大合成材料是( )
| A. | 合成橡胶 | B. | 塑料 | C. | 合成纤维 | D. | 陶瓷 |
6.下列物质含有丰富维生素C的是( )
| A. | 牛肉 | B. | 芹菜 | C. | 鸡蛋 | D. | 牛奶 |
3.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的一种单质是自然界中硬度最大的物质 | |
| C. | 元素Y的单质只能与盐酸等酸反应生成氢气,而不能和碱反应 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
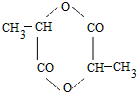
5.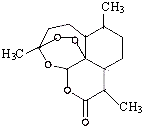 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )| A. | 青蒿素与维生素C一样易溶于水 | |
| B. | 青蒿素的晶体为分子晶体,其化学式为C16H20O5 | |
| C. | 青蒿素不能与NaOH溶液反应 | |
| D. | 青蒿素分子有7个手性碳原子 |
 ,D
,D ;
; ;
; ;
;