题目内容
15.发射航天器常以联氨(N2H4)为燃料,NO2为推进剂,燃烧生成氮气和水蒸气,火焰温度可达+22700°C,已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ•mol-1①N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534KJ•mol-1②
H2O(g)═H2O(1)AH=-44kJ-mol-1 ③
2H2O2(1)═2H20(1)+O2(g)△H=-196.4KJ•mol-1④
$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)═HF(g)△H=-269KJ•mol-1⑤
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242KJ•mol-1⑥
请回答下列问题:
(1)对N2H4和NO2反应的说法不正确的是C
A.N2H4与NO2反应时NO2作氧化剂
B.氮气既是氧化产物,又是还原产物
C.生成lmolN2转移8mol电子
D.该反应的热化学方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ•mol-1
(2)以往也曾用H2O2为助燃剂.试写出N2H4和H2O2反应生成气态水的热化学方程式:N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1.若生成1mol液态水放出热量204.6kJ
(3)有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大.试写出联氨与氟气反应的热化学方程式:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1.
分析 (1)将反应②×2-①可得2N2H4+2NO2=3N2+4H2O,反应中只有N元素化合价发生变化,为NO2氧化剂,N2H4为还原剂;
(2)将②+③×2+④可得N2H4和H2O2反应生成液态水的热化学方程式,并结合③得到生成气态水的热化学方程式;
(3)将②-⑤×3+⑥×4可得联氨与氟气反应的热化学方程式.
解答 解:(1)将反应②×2-①可得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ•mol-1,反应中只有N元素化合价发生变化,为NO2氧化剂,N2H4为还原剂,由方程式可知生成3molN2转移8mol电子,只有C错误,
故答案为:C;
(2)将②+③×2+④可得N2H4和H2O2反应生成液态水,反应的热化学方程式为N2H4(g)+2H2O2(1)=N2(g)+4H2O(l)△H=-818.4KJ•mol-1,
则生成气态水的热化学方程式为N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1,
生成1mol液态水放出热量为$\frac{818.4}{4}$kJ=204.6kJ,
故答案为:N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1;204.6;
(3)将②-⑤×3+⑥×4可得联氨与氟气反应的热化学方程式为2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1,
故答案为:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1.
点评 本题考查较为综合,涉及化学反应与能量以及氧化还原反应知识,题目难度中等,注意把握盖斯定律的应用以及热化学方程式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列有关说法正确的是( )
| A. | 苯酚俗名石炭酸,向苯酚溶液中滴入石蕊试液溶液变浅红色 | |
| B. | 将金属钠放入乙醇中,反应较缓和且钠在液面下 | |
| C. | 既能够与酸反应又能够与碱反应的物质是两性化合物 | |
| D. | 淀粉、脂肪和纤维素都是天然高分子化合物 |
20.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述错误的是( )
| A. | 负极附近SO42- 逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 反应一段时间后,溶液的H+浓度降低 | |
| D. | 铜片上有H2逸出 |
7.下列说法正确的是( )
| A. | 丙氨酸与苯丙氨酸脱水,最多可以生成3种二肽 | |
| B. | 对苯二甲酸(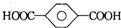 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( 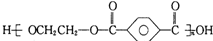 ) ) | |
| C. | 迷迭香酸的结构为 它可以发生酯化、水解、加成、取代、氧化等反应 它可以发生酯化、水解、加成、取代、氧化等反应 | |
| D. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |
5.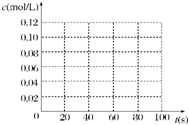 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
(1)该反应的平衡常数表达式为K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
从表中分析:c1<c2;c3=c4(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol/(L•s).
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是B
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He.
 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
从表中分析:c1<c2;c3=c4(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为0.001mol/(L•s).
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是B
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He.
 .
.
 .
.